网址:http://m.1010jiajiao.com/timu3_id_41480[举报]
 某研究性学习小组在研究由Fe2+制备Fe(OH)2的过程中,设计了如下实验方案:
某研究性学习小组在研究由Fe2+制备Fe(OH)2的过程中,设计了如下实验方案:[实验设计]
方法一:按照图1进行实验,容器A中的反应开始时,弹簧夹C处于打开状态,一段时间后,关闭弹簧夹C,容器A中的反应仍在进行.最终在
方法二:按图2进行实验,最终在两极间的溶液中首先观察到白色沉淀.请从所提供的试剂或电极材料中选择正确的序号填在横线上:
①纯水 ②NaCl溶液 ③NaOH溶液 ④四氯化碳 ⑤CuCl2溶液 ⑥乙醇 ⑦Fe棒 ⑧植物油 ⑨碳棒
a为
[探究思考]实验表明上述实验中出现白色的沉淀会逐渐转变为灰绿色或绿色,那么如何解释出现灰绿色或绿色的现象呢?
(1)甲同学查阅资料后,得到Fe(OH)2如下信息:
| 资料名称 | 物理性质描述 | 化学性质描述 |
| 《化学辞典》,顾翼东编,1989年版P637 | 白色无定形粉末或白色至淡绿色六方晶体 | 与空气接触易被氧化,将细粉喷于空气中,则立即燃烧出火花 |
| 《大学普通化学(下册)》傅鹰著P637 | 白色沉淀 | 此沉淀易被氧化成微绿色Fe3(OH)8 |
| 《普通化学教程》(下册)P788 | 白色 | 能强烈吸收O2,迅速变成棕色Fe(OH)3.这时作为氧化的中间产物为土绿色,其中含有Fe2+、Fe3+. |
(2)乙同学依据配色原理:白色和棕色不可能调配成绿色或灰绿色的常识,认为绿色可能是形成Fe(OH)2?nH2O所致.用热水浴的方式加热“方法一”中生成的绿色沉淀,观察到沉淀由绿变白的趋势.
加热时,“方法一”中弹簧夹C应处于
| ||
| ||
(3)欢迎你参加该研究小组的讨论,请提出一种在研究由Fe2+制备Fe(OH)2的过程中,有助于对沉淀由“白”变“绿”的现象进行合理解释的实验设计新思路.
某研究性学习小组为探究铜、锌与浓盐酸反应,设计实验探究方案如下:
(一)实验用品:纯锌片、铜片、37%的浓盐酸、蒸馏水、氯化铜溶液
(二)实验记录:

(三)背景资料

(四)请你参与以下探究
(1)实验A反应速度明显比B小,原因是________.
(2)根据“铜位于金属活动顺序表氢之后,与稀盐酸不反应,而在实验C中加热时又产生气体”的事实,作出如下推断:
①有同学认为“实验C中加热时产生的气体是溶解在溶液中的H2”,你认为是否有道理?________(填是或否),理由是________.
②某同学作了如下猜想:是否成立?请你设计实验方案加以验证.

(3)某同学对实验D中的白色沉淀进行分析:“不可能是CuCl2,因为CuCl2能溶于水且溶液显蓝色;也不可能是ZnCl2,因为稀释后溶液更稀,不会析出ZnCl2晶体.若利用资料卡片资料①②大胆猜想,白色沉淀可能是CuCl.请你帮他设计验证方案.

(4)指导老师肯定了实验D中的白色沉淀是CuCl,并指出生成沉淀的原因,实际上是沉淀溶解平衡:[CuCl4]3-(aq)![]() CuCl(s)+3Cl-(aq)移动的结果.请写出该平衡常数的表达式K=________;加水稀释后平衡移动的原因是________.
CuCl(s)+3Cl-(aq)移动的结果.请写出该平衡常数的表达式K=________;加水稀释后平衡移动的原因是________.
某校化学研究性学习小组的同学在学习了氨的性质持讨论:运用类比的思想,既然氨气具有还原性,能否像H2那样还原CuO呢?他们设计实验制取氨气并探究上述问题.请你参与该小组的活动并完成下列研究:
(一)制取氨气
(1)写出实验制取氨气的化学方程式________;
(2)在实验室中,还可以用浓氨水与________(填写一种试剂)快速制取少量氨气;
(3)有同学模仿排饱和食盐水收集氯气的方法,想用排饱和氯化铵溶液的方法收集氨气.
你认为他能否达到目的?________(填“能”或“否”),理由是____________.
(二)实验探究
该小组中某同学设计了下图所示的实验装置(夹持及尾气处理装置未画出),探究氨气的还原性:
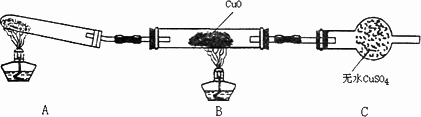
该装置在设计上有一定缺陷,可以采取的的改进措施是__________________.
利用改进后的装置进行实验,观察到CuO变为红色物质,无水CuSO4变蓝色,同时生成一种无污染的N2.
(三)问题讨论
(1)有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O.已知:Cu2O是一种碱性氧化物;在酸性溶液中,Cu+的稳定性比Cu2+差(Cu+→Cu+Cu2+).请你设计一个简单的实验检验该红色物质中是否含有Cu2O.________;
(2)在解决了问题(1)后,又有同学提出:Cu2O与CuO的热稳定性哪个更强?于是
他们进行了如下实验:取98 g Cu(OH)2固体,加热至80℃~100℃时,得到黑色固体粉末,继续加热到1 000℃以上,黑色粉末全部变为红色粉末A.冷却后称量,A的质量为72 g.据此可推得,A的化学式为________.由此,得到的结论是________.
(四)兴趣探究
将铜丝的一端绕成螺旋状,在酒精灯外焰加热,冷却后变黑.再在酒精灯上将该铜丝加热至红热状态.如下图所示,趁热插入到试管里的氯化铵晶体中,在试管中出现白烟.冷却后取出铜丝变成亮红色.
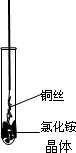
(1)试管中出现白烟的有关化学方程式为____________.
(2)铜丝灼热后在氯化铵中由黑变红的有关化学方程式___________.
(一)实验用品:纯铝片、饱和氯化铜溶液
(二)实验记录:
| 1.将铝片放入饱和氯化铜溶液中,反应较快,浸在溶液中的铝片表面迅速生成蓬松的红色固体,同时在液面处的铝片以及有液体飞溅到上部的铝片表面有黑色物质生成.2.有大量气泡产生,在一段时间内产生气泡越来越快,将其收集并点燃发出爆鸣声.3.有少量蓝色悬浊液产生. |
(四)请你根据所学知识参与并完成该实验的以下探究、拓展及应用:
(1)在一段时间内气泡产生越来越快的主要原因是:
(2)该实验中有少量蓝色悬浊液和大量气体生成的原因是(用离子方程式表示):
(3)该小组设计实验对反应进行一段时间后的混合液体进行分离、提纯,以得到纯净的AlCl3和CuCl2.实验步骤如图:
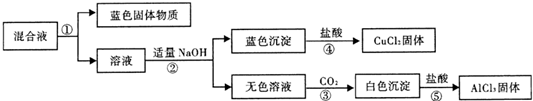
请你完成:
1)在①、②、③中进行的实验操作均相同,其名称是
2)操作②中生成无色溶液的化学方程式为
3)以下是操作④、⑤制取无水AlCl3和CuCl2固体的部分装置(铁架台、加热装置等已略去)
i.该装置如下图,装置a由
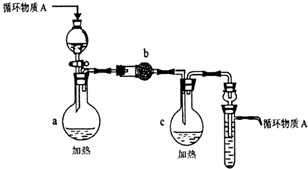
ii.无水AlCl3和CuCl2是在装置c中制得的,但需在氯化氢存在的条件下进行该操作,目的是
(4)请你选用中学化学中常用药品(试剂),填写下表,完成该小组探究反应过程中铝表面的黑色物质的实验方案.(提示:该小组同学猜想可能是Cu或CuO或两种混合物)
| 预设验证方法 | 猜想的现象 | 结论 |
| 取适量覆盖有黑色物质的铝片于试管中, |
黑色物质含铜,可能是纳米铜 |
某研究性学习小组为探究铜、锌与浓盐酸反应,设计实验探究方案如下:
(一)实验用品:纯锌片、铜片、37%的浓盐酸、蒸馏水、氯化铜溶液
(二)实验记录:
交流卡片
|
(三)背景资料
资料卡片
|
(四)请你参与以下探究
(1)实验A反应速度明显比B小,原因是 。
(2)根据“铜位于金属活动顺序表氢之后,与稀盐酸不反应,而在实验C中加热时又产生气体”的事实,作出如下推断:
① 有同学认为“实验C中加热时产生的气体是溶解在溶液中的H2”,你认为是否有道理? (填是或否),理由是 。
② 某同学作了如下猜想:是否成立?请你设计实验方案加以验证。
猜想 | 验证方法 | 预测现象及结论 |
认为铜片中可能含有锌等杂质 |
|
|
(3)某同学对实验D中的白色沉淀进行分析:“不可能是CuCl2,因为CuCl2能溶于水且溶液显蓝色;也不可能是ZnCl2,因为稀释后溶液更稀,不会析出ZnCl2晶体”。利用资料卡片资料①、②大胆猜想,白色沉淀可能是CuCl。请你帮他设计验证方案。
猜想 | 预设验证方法 | 猜想的现象与结论 |
白色沉淀 是氯化亚铜 |
|
|
(4)指导老师肯定了实验D中的白色沉淀是CuCl,并指出生成沉淀的原因,实际上是沉淀溶解平衡:[CuCl4]3- (aq)![]() CuCl (s) + 3Cl- (aq) 移动的结果。请写出该平衡常数的表达式K= ;
CuCl (s) + 3Cl- (aq) 移动的结果。请写出该平衡常数的表达式K= ;
加水稀释后平衡移动的原因是 。
查看习题详情和答案>>