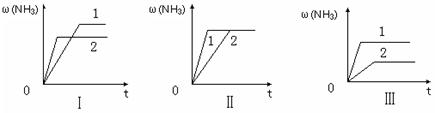
摘要:18.氨在国民经济中占有重要的地位.请参与下列探究. (1)生产氢气:将水蒸气通过红热的炭即产生水煤气. C(s) + H2O(g) H2 △H = +131.3 kJ .△S = +133.7 J/K 该反应在低温下能否自发 . (2)已知在400℃时.N2 (g)+ 3H2(g) 2NH3(g)的K=0.5, ①2NH3(g)N2 (g)+ 3H2(g)的K= . ②400℃时.在0.5L的反应容器中进行合成氨反应.一段时间后.测得N2.H2.NH3的物质的量分别为2mol.1mol.2mol.则此时反应V(N2)正 V(N2)逆 (3)在三个相同容器中各充入1 molN2和3molH2.在某一不同条件下反应并达到平衡.氨的体积分数随时间变化曲线如下图.下列说法正确的是 . A.图Ⅰ可能是不同压强对反应的影响.且P2>P1 B.图Ⅱ可能是不同压强对反应的影响.且P1>P2 C.图Ⅲ可能是不同温度对反应的影响.且T1>T2 D.图Ⅱ可能是同温同压下.催化剂性能.1>2
网址:http://m.1010jiajiao.com/timu3_id_41458[举报]
氨在国民经济中占有重要的地位,请参与下列探究
(1)已知在400℃时,2NH3(g)?N2 (g)+3H2(g) (△H>0)的平衡常数K=2,
①400℃时,N2 (g)+3H2(g)?2NH3(g)的K=
②400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应V(NH3)正
(2)已知:H2(g)+
O2(g)=H2O(l)△H=-285.8kJ?mol-1…①
O2(g)+
N2(g)=NO2(g)△H=+33.9kJ?mol-1…②
H2(g)+
N2(g)=NH3(g)△H=-46.0kJ?mol-1…③
H2O(l)=H2O(g)△H=+44kJ?mol-1…④
则表示NH3燃烧热的热化学方程式为
查看习题详情和答案>>
(1)已知在400℃时,2NH3(g)?N2 (g)+3H2(g) (△H>0)的平衡常数K=2,
①400℃时,N2 (g)+3H2(g)?2NH3(g)的K=
0.5
0.5
(填数值).②400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应V(NH3)正
=
=
V(NH3)逆(填:>、<、=、不能确定).(2)已知:H2(g)+
| 1 |
| 2 |
O2(g)+
| 1 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
H2O(l)=H2O(g)△H=+44kJ?mol-1…④
则表示NH3燃烧热的热化学方程式为
NH3(g)+
O2(g)=
N2(g)+
H2O(l);△H=-382.7kJ/mol
| 3 |
| 4 |
| 1 |
| 2 |
| 3 |
| 2 |
NH3(g)+
O2(g)=
N2(g)+
H2O(l);△H=-382.7kJ/mol
.| 3 |
| 4 |
| 1 |
| 2 |
| 3 |
| 2 |
氨在国民经济中占有重要的地位,请参与下列探究.
(1)合成氨反应N2(g)+3H2(g)?2NH3(g),该反应为放热反应,若在恒温、恒压条件下向平衡体系中通入氩气,则平衡
(2)已知在400℃时,N2(g)+3H2(g)?2NH3(g)的K=0.5,则①2NH3(g)?N2(g)+3H2(g)的K=
②400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为4mol、2mol、4mol;则此时反应v(N2)正
(3)在三个相同容器中各充入1 molN2和3molH2,在某一不同条件下反应并达到平衡,氨的体积分数随时间变化曲线如图.下列说法正确的是
A.图Ⅰ可能是不同压强对反应的影响,且P2>Pl
B.图Ⅱ可能是不同压强对反应的影响,且Pl>P2
C.图Ⅲ可能是不同温度对反应的影响,且T1>T2
D.图Ⅱ可能是同温同压下,催化剂性能,1>2.
查看习题详情和答案>>
(1)合成氨反应N2(g)+3H2(g)?2NH3(g),该反应为放热反应,若在恒温、恒压条件下向平衡体系中通入氩气,则平衡
向左
向左
移动(填“向左”“向右”或“不”);使用催化剂,上述反应的△H不改变
不改变
(填“增大”“减小”或“不改变”).(2)已知在400℃时,N2(g)+3H2(g)?2NH3(g)的K=0.5,则①2NH3(g)?N2(g)+3H2(g)的K=
2
2
(填数值).②400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为4mol、2mol、4mol;则此时反应v(N2)正
=
=
v(N2)逆(填:“>”、“<”、“=”或“不能确定”)(3)在三个相同容器中各充入1 molN2和3molH2,在某一不同条件下反应并达到平衡,氨的体积分数随时间变化曲线如图.下列说法正确的是
D
D
(填序号).
A.图Ⅰ可能是不同压强对反应的影响,且P2>Pl
B.图Ⅱ可能是不同压强对反应的影响,且Pl>P2
C.图Ⅲ可能是不同温度对反应的影响,且T1>T2
D.图Ⅱ可能是同温同压下,催化剂性能,1>2.
氨在国民经济中占有重要的地位,请参与下列探究.
(1)生产氢气:将水蒸气通过红热的炭即产生水煤气.C(s)+H2O(g)?H2(g)+CO(g)△H=+131.3kJ/mol,△S=+133.7J/K
该反应在低温下能否自发 (填:能或否).
(2)已知在400℃时,N2 (g)+3H2(g)?2NH3(g)△H<0 的K1=0.5,
①2NH3(g)?N2 (g)+3H2(g)的K2= (填数值).
②400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应V(N2)正 V(N2)逆(填:>、<、=、不能确定).
(3)已知反应:CO(g)+2H2(g)?CH3OH (g)△H<0
a.该反应在一定条件下达到平衡后,在保证H2浓度不变的情况下,增大容器的体积,试根据平衡常数,判断平衡
A.向正反应方向移动 B.向逆反应方向移动 C.不移动
b.若该反应的逆反应速率与时间的关系如图所示:
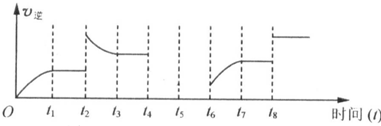
t2时的平衡常数K与t1时的相比可能 (填字母代号)
A.增大 B.减小 C.不变.
查看习题详情和答案>>
(1)生产氢气:将水蒸气通过红热的炭即产生水煤气.C(s)+H2O(g)?H2(g)+CO(g)△H=+131.3kJ/mol,△S=+133.7J/K
该反应在低温下能否自发
(2)已知在400℃时,N2 (g)+3H2(g)?2NH3(g)△H<0 的K1=0.5,
①2NH3(g)?N2 (g)+3H2(g)的K2=
②400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应V(N2)正
(3)已知反应:CO(g)+2H2(g)?CH3OH (g)△H<0
a.该反应在一定条件下达到平衡后,在保证H2浓度不变的情况下,增大容器的体积,试根据平衡常数,判断平衡
A.向正反应方向移动 B.向逆反应方向移动 C.不移动
b.若该反应的逆反应速率与时间的关系如图所示:

t2时的平衡常数K与t1时的相比可能
A.增大 B.减小 C.不变.
氨在国民经济中占有重要的地位,请参与下列探究.
(1)生产氢气:将水蒸气通过红热的炭即产生水煤气.
C(s)+H2O(g)?H2(g)+CO(g)△H=+131.3kJ,△S=+133.7J/K
该反应在低温下能否自发 (填:能或否).
(2)已知在400℃时,N2 (g)+3H2(g)?2NH3(g)的K=0.5,
①2NH3(g)?N2 (g)+3H2(g)的K= (填数值).
②400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应V(N2)正 V(N2)逆(填:>、<、=、不能确定)
(3)在三个相同容器中各充入1molN2和3molH2,在某一不同条件下反应并达到平衡,氨的体积分数随时间变化曲线如图.下列说法正确的是 (填序号).
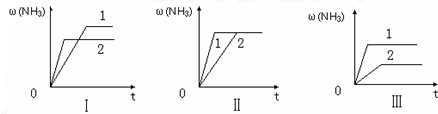
A.图Ⅰ可能是不同压强对反应的影响,且P2>P1
B.图Ⅱ可能是不同压强对反应的影响,且P1>P2
C.图Ⅲ可能是不同温度对反应的影响,且T1>T2
D.图Ⅱ可能是同温同压下,催化剂性能,1>2.
查看习题详情和答案>>
(1)生产氢气:将水蒸气通过红热的炭即产生水煤气.
C(s)+H2O(g)?H2(g)+CO(g)△H=+131.3kJ,△S=+133.7J/K
该反应在低温下能否自发
(2)已知在400℃时,N2 (g)+3H2(g)?2NH3(g)的K=0.5,
①2NH3(g)?N2 (g)+3H2(g)的K=
②400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应V(N2)正
(3)在三个相同容器中各充入1molN2和3molH2,在某一不同条件下反应并达到平衡,氨的体积分数随时间变化曲线如图.下列说法正确的是

A.图Ⅰ可能是不同压强对反应的影响,且P2>P1
B.图Ⅱ可能是不同压强对反应的影响,且P1>P2
C.图Ⅲ可能是不同温度对反应的影响,且T1>T2
D.图Ⅱ可能是同温同压下,催化剂性能,1>2.
氨在国民经济中占有重要的地位,请参与下列探究。
(1)生产氢气:将水蒸气通过红热的炭即产生水煤气。
C(s) + H2O(g) ![]() H2(g) + CO(g) △H = +131.3 kJ ,△S = +133.7 J/K
H2(g) + CO(g) △H = +131.3 kJ ,△S = +133.7 J/K
该反应在低温下能否自发 (填:能或否)。
(2)已知在400℃时,N2 (g)+ 3H2(g) ![]() 2NH3(g)的K=0.5,
2NH3(g)的K=0.5,
①2NH3(g)![]() N2 (g)+ 3H2(g)的K= (填数值)。
N2 (g)+ 3H2(g)的K= (填数值)。
②400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应V(N2)正 V(N2)逆(填:>、<、=、不能确定)
(3)在三个相同容器中各充入1 molN2和3molH2,在某一不同条件下反应并达到平衡,氨的体积分数随时间变化曲线如下图。下列说法正确的是 (填序号) 。
A.图Ⅰ可能是不同压强对反应的影响,且P2>P1
B.图Ⅱ可能是不同压强对反应的影响,且P1>P2
C.图Ⅲ可能是不同温度对反应的影响,且T1>T2
D.图Ⅱ可能是同温同压下,催化剂性能,1>2