网址:http://m.1010jiajiao.com/timu3_id_41245[举报]

(1)Z2的结构式是
| ||
| ||
(2)反应③的离子方程式是
(3)D是很多漂白剂中含有的有效成分,这些产品不能与洁厕灵(含有有机酸和无机酸)一起使用,其原因就是在常温时能发生与反应②相似的反应.某校的学生在实验室利用反应②的原理来制备纯净、干燥的Z2,仪器装置如图乙所示(夹持固定装置的仪器已略去).
I、写出反应②的离子方程式
II、上述实验装置不够完善,改进方法是
Ⅲ、足量Z2 通入FeBr2溶液中发生反应的离子方程式是
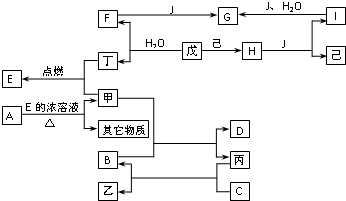 已知A、B、C、D、E、F、G、H、I、J是化合物,甲、已、丙、丁、戊、己是单质.其中,F、H、G、I焰色反应火焰呈黄色,B、C、D焰色反应透过钴玻璃观察火焰呈紫色,H是淡黄色固体.各物质间有如图所示的转化关系.
已知A、B、C、D、E、F、G、H、I、J是化合物,甲、已、丙、丁、戊、己是单质.其中,F、H、G、I焰色反应火焰呈黄色,B、C、D焰色反应透过钴玻璃观察火焰呈紫色,H是淡黄色固体.各物质间有如图所示的转化关系.(1)乙遇淀粉溶液变成蓝色,C物质的化学式是
(2)写出下列反应的方程式,是离子反应的写离子反应方程式:
I→G:
F+甲:
丙+C:
H+J:
(3)若A是一种钾盐,其水溶液显紫色.此时,A与E的浓溶液可反应制得甲,反应式可表示为:A+E→X+Y+甲+H2O,其中X、Y的化学式分别
已知X、Y、Z为三种由短周期元素构成的粒子,每摩粒子都有10mol电子,其结构特点如下:
| X | Y | Z | |
| 原子核数 | 单核 | 四核 | 双核 |
| 粒子的电荷数 | 1个单位正电荷 | 0 | 1个单位负电荷 |
现有A、B、C、D、E、F、G、H、I、J、K等物质,它们之间的相互反应转化关系如下图所示下图所示:
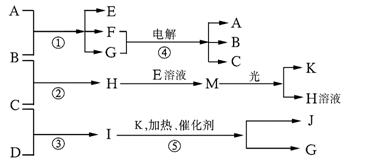
已知物质A由X、Z构成, B、C、D、K都是单质,G为无色液体,I的水溶液呈碱性,反应①~⑤都是用于工业生产的反应,请回答下列问题:?
(1) A的电子式为 ;D的结构式为 。
(2)物质B的组成元素在元素周期表中的位置是 。
(3)反应①的化学方程式为 。?
反应④离子方程式为 。?
(4)H和I反应的生成物的水溶液呈酸性,其原因是 (用一个离子反应方程式表示)
(5)已知每生成1mol I放出46.0kJ的热量,则反应③的热化学方程式为 。
查看习题详情和答案>>已知A—O分别代表一种物质,它们之间的转化关系如下图所示(反应条件略)。A、B、H分别是由短周期元素组成的单质。B与冷水缓慢反应,与沸水迅速反应,放出氢气。D是一种离子化合物,其阴阳离子的个数比为2:3,且能与水反就应得到两种碱。C为淡黄色固体化合物,O能与G的水溶液反应生成蓝色沉淀。请回答下列问题:
⑴组成B单质的元素位于周期表位置________________。化合物C电子式为____________。
⑵J的沸点比硒化氢(H2Se)的熔沸点高,其原因是_________________。
⑶I与H在一定条件下也可直接反应生成L和J, 写出化学方程式:_______________。
⑷写出D与水反应的化学方程式:_____________________。
⑸红棕色污染气体M的处理具有实际意义。现在常利用反应
M + NH3N2+H2O(方程没配平)来处理M。当转移0.4mol电子时,消耗的M在标准状况下是 L。
查看习题详情和答案>>
已知A—O分别代表一种物质,它们之间的转化关系如下图所示(反应条件略)。A、B、H分别是由短周期元素组成的单质。B与冷水缓慢反应,与沸水迅速反应,放出氢气。D是一种离子化合物,其阴阳离子的个数比为2:3,且能与水反就应得到两种碱。C为淡黄色固体化合物,O能与G的水溶液反应生成蓝色沉淀。请回答下列问题:
⑴组成B单质的元素位于周期表位置________________。化合物C电子式为____________。
⑵J的沸点比硒化氢(H2Se)的熔沸点高,其原因是_________________。
⑶I与H在一定条件下也可直接反应生成L和J, 写出化学方程式:_______________。
⑷写出D与水反应的化学方程式:_____________________。
⑸红棕色污染气体M的处理具有实际意义。现在常利用反应
M + NH3N2+H2O(方程没配平)来处理M。当转移0.4mol电子时,消耗的M在标准状况下是 L。
查看习题详情和答案>>