摘要:铁钉镀锌 (1)该实验为无氰镀锌法.以烧杯作为电解槽.锌片作阳极.镀件铁钉作阴极. 阳极反应式 .阴极反应式 . (2)实验仪器:托盘天平.烧杯.玻璃棒.药匙.导线.细纱纸.直流电源. 酒精灯.pH试纸 (3)实验试剂:铁钉.锌片.2mol/LNaOH溶液.固体KCl.固体ZnCl2.浓HCl.浓硝酸.蒸馏水 (4)电解液的配制:先向烧杯中加入50ml蒸馏水.再加入3.5g ZnCl2.12.5gKCl.搅拌使之溶解你认为KCl的作用可能为 .用硼酸或盐酸调节溶液的pH为5-6.pH太高会 .pH太低会 . 镀前处理大致包括以下基本内容:除油.除锈.除氧化层.浸蚀.酸洗.活化等. (5)镀件的处理:用细砂纸打磨铁钉.使铁钉粗糙的表面变得光滑.用水洗净,把铁钉放入到80℃ 2mol/L NaOH溶液中浸泡5分钟.除去油污.用水洗净,再将铁钉放入45℃的浓盐酸中浸泡2分钟.取出.洗净,最后将铁钉放入V=1:100的稀硝酸中浸泡3-5秒.取出.洗净.你认为把镀件放入稀硝酸的作用是 . (6)电镀操作:用烧杯做电解槽.锌片作阳极.镀件铁钉作阴极.接通6V的支流电源.电解25分钟.
网址:http://m.1010jiajiao.com/timu3_id_412310[举报]
某研究小组模拟工业无隔膜电解法处理电镀含氰废水,进行以下有关实验,回答下列问题.
(1)实验I 制取次氯酸钠溶液,用石墨作电极电解饱和氯化钠溶液制取次氯酸钠溶液,生成次氯酸钠的离子方程式为 .
实验Ⅱ测定含氰废水处理百分率,利用如图所示装置进行实验:将CN-的浓度为0.2000mol?L-1的含氰废水100mL与l00mL NaClO溶液(过量)置于装置②锥形瓶中充分反应,打开分液漏斗活塞,滴入100ml,稀H2SO4,关闭活塞.
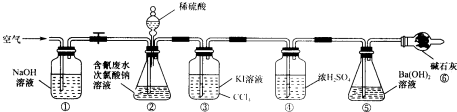
已知装置②中发生的主要反应依次为:
CN-+ClO-═CNO+Cl-
2CNO-+2H++3ClO-═N2↑+2CO2↑+3Cl-+H2O
(2)装置③的作用是 ,装置⑥的作用是 .
(3)反应结束后,缓缓通入空气的目的是 .
(4)为计算该实验中含氰废水被处理的百分率,需要测定 的质量.
(5)上述实验完成后,为了回收装置③中的CCl4需要的操作是 .
(6)若要研究装置②中所加稀硫酸的最佳浓度,请填写该装置进行实验的记录表.要求:①在进行理论判断后,将理论浓度作为第一组实验数据;②记录表要体现实验过程中的不变量、自变量、因变量.
查看习题详情和答案>>
(1)实验I 制取次氯酸钠溶液,用石墨作电极电解饱和氯化钠溶液制取次氯酸钠溶液,生成次氯酸钠的离子方程式为
实验Ⅱ测定含氰废水处理百分率,利用如图所示装置进行实验:将CN-的浓度为0.2000mol?L-1的含氰废水100mL与l00mL NaClO溶液(过量)置于装置②锥形瓶中充分反应,打开分液漏斗活塞,滴入100ml,稀H2SO4,关闭活塞.

已知装置②中发生的主要反应依次为:
CN-+ClO-═CNO+Cl-
2CNO-+2H++3ClO-═N2↑+2CO2↑+3Cl-+H2O
(2)装置③的作用是
(3)反应结束后,缓缓通入空气的目的是
(4)为计算该实验中含氰废水被处理的百分率,需要测定
(5)上述实验完成后,为了回收装置③中的CCl4需要的操作是
(6)若要研究装置②中所加稀硫酸的最佳浓度,请填写该装置进行实验的记录表.要求:①在进行理论判断后,将理论浓度作为第一组实验数据;②记录表要体现实验过程中的不变量、自变量、因变量.
| 实验 | c(H2SO4)mol.L-1 | V(H2SO4)mL | V(NaClO)mL | 含氯废水的体积mL |
| 1 | 100 | 100 | ||
| 2 | 0.0500 | 100 | 100 | |
| 3 | 0.2000 | 100 | 100 |
某研究小组模拟工业无隔膜电解法处理电镀含氰废水,进行以下有关实验.填写下列空白:
实验Ⅰ:制取次氯酸钠溶液.
用石墨做电极电解饱和氯化钠溶液制取次氯酸钠溶液,设计图1所示装置进行实验.
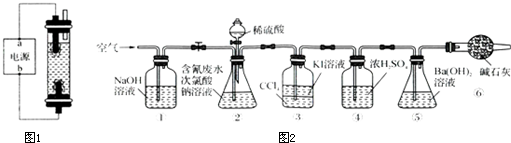
(1)电源中,a电极名称是 .
(2)反应时,生成次氯酸钠的离子方程式为 .
实验Ⅱ:测定含氰废水处理百分率.
利用所示装置(图2)进行实验.将CN-的浓度为0.200 0mol?L-1的含氰废水100mL与100mL NaClO溶液(过量)置于装置②锥形瓶中充分反应.打开分液漏斗活塞,滴入100mL稀H2SO4,关闭活塞.
已知装置②中发生的主要反应依次为:CN-+ClO-═CNO-+Cl-,2CNO-+2H++3ClO-═N2↑+2CO2↑+3Cl-+H2O
(3)①和⑥的作用是 .
(4)装置②中,生成需由装置③除去的物质的离子方程式为 .
(5)反应结束后,缓缓通入空气的目的是 .
(6)为计算该实验中含氰废水被处理的百分率,需要测定 的质量.
(7)上述实验完成后,为了回收装置③中的CCl4需要的操作是 .
(8)若要研究装置②中所加稀硫酸的最佳浓度,请设计利用该装置进行实验的记录表.
要求:①在进行理论判断后,将理论浓度作为第一组实验数据;②记录表要体现实验过程中的不变量、自变量、因变量;③可将提供的方框作为表的外边框使用.
 查看习题详情和答案>>
查看习题详情和答案>>
实验Ⅰ:制取次氯酸钠溶液.
用石墨做电极电解饱和氯化钠溶液制取次氯酸钠溶液,设计图1所示装置进行实验.

(1)电源中,a电极名称是
(2)反应时,生成次氯酸钠的离子方程式为
实验Ⅱ:测定含氰废水处理百分率.
利用所示装置(图2)进行实验.将CN-的浓度为0.200 0mol?L-1的含氰废水100mL与100mL NaClO溶液(过量)置于装置②锥形瓶中充分反应.打开分液漏斗活塞,滴入100mL稀H2SO4,关闭活塞.
已知装置②中发生的主要反应依次为:CN-+ClO-═CNO-+Cl-,2CNO-+2H++3ClO-═N2↑+2CO2↑+3Cl-+H2O
(3)①和⑥的作用是
(4)装置②中,生成需由装置③除去的物质的离子方程式为
(5)反应结束后,缓缓通入空气的目的是
(6)为计算该实验中含氰废水被处理的百分率,需要测定
(7)上述实验完成后,为了回收装置③中的CCl4需要的操作是
(8)若要研究装置②中所加稀硫酸的最佳浓度,请设计利用该装置进行实验的记录表.
要求:①在进行理论判断后,将理论浓度作为第一组实验数据;②记录表要体现实验过程中的不变量、自变量、因变量;③可将提供的方框作为表的外边框使用.
 查看习题详情和答案>>
查看习题详情和答案>>
某研究小组模拟工业无隔膜电解法处理电镀含氰废水,进行以下有关实验,回答下列问题.
(1)实验I 制取次氯酸钠溶液,用石墨作电极电解饱和氯化钠溶液制取次氯酸钠溶液,生成次氯酸钠的离子方程式为______.
实验Ⅱ测定含氰废水处理百分率,利用如图所示装置进行实验:将CN-的浓度为0.2000mol?L-1的含氰废水100mL与l00mL NaClO溶液(过量)置于装置②锥形瓶中充分反应,打开分液漏斗活塞,滴入100ml,稀H2SO4,关闭活塞.

已知装置②中发生的主要反应依次为:
CN-+ClO-═CNO+Cl-
2CNO-+2H++3ClO-═N2↑+2CO2↑+3Cl-+H2O
(2)装置③的作用是______,装置⑥的作用是______.
(3)反应结束后,缓缓通人空气的目的是______.
(4)为计算该实验中含氰废水被处理的百分率,需要测定______的质量.
(5)上述实验完成后,为了回收装置③中的CCl4需要的操作是______.
(6)若要研究装置②中所加稀硫酸的最佳浓度,请填写该装置进行实验的记录表.要求:①在进行理论判断后,将理论浓度作为第一组实验数据;②记录表要体现实验过程中的不变量、自变量、因变量.
| 实验 | c(H2SO4)mol.L-1 | V(H2S O4)mL | V(NaClO)mL | 含氯废水的体积mL |
| 1 | ______ | 100 | ______ | 100 |
| 2 | 0.0500 | ______ | 100 | 100 |
| 3 | 0.2000 | ______ | 100 | 100 |
某科学实验小组欲用如下图所示的实验装置来验证牺牲阳极的阴极保护法的原理.已知:
3Fe2++2Fe(CN)63-(黄色)
实验步骤如下:
[实验I]向100 mL烧杯中加入约50 mL饱和食盐水后,插入两个玻璃筒(无底).将一根锌棒和一根铁棒用导线与电流计连接后,再分别插入两个玻璃筒中,可以看到电流计指针发生偏转.
(1)电流计指针发生偏转的原因是________.锌棒上发生的反应为________,铁棒上发生的反应为________.
(2)可以证明该实验中无Fe2+产生的现象是________.
[实验II]为了进一步探究金属腐蚀的原理,该小组的同学又做了如下实验:
a.向100 mL烧杯中加入约50 mL饱和食盐水后,插入两个玻璃筒(无底);
b.将一根铜棒与一根铁棒用导线与电流计连接后,再分别插入两个玻璃筒中;
c.1 min后,向插入铁棒的玻璃筒内滴入2~3滴K3[Fe(CN)6]溶液;
d.向插入铜棒的玻璃筒内滴入酚酞溶液.
(3)b步骤中观察到电流计指针偏转但其偏转方向与实验I相反,表明________.
(4)c步骤中观察到的现象是________,表明________.
(5)d步骤中观察到的现象是________,表明________.
(6)通过上述实验可以得出的结论是________.
 铁是人类生产和生活中必不可少的重要金属(如图).
铁是人类生产和生活中必不可少的重要金属(如图).(1)自然界一共存在四种稳定的铁原子,分别是54Fe、56Fe、57Fe和58Fe,其中58Fe原子中子数与质子数之差为
(2)铁原子中有
(3)与铁同周期的主族元素中,最高价氧化物对应水化物中,碱性最强的化合物与酸性最强的化合物的化学反应方程式为
(4)要用铁片、锌片、直流电源和导线完成铁片镀锌的实验,铁片应置于
(5)高铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原为Fe3+,配平制取高铁酸钠的化学方程式:
(6)0.03mol的铁加到过量的HNO3中,加热,铁完全溶解,若生成NO、NO2的混和气体共1.12L(标准状况).将盛有此气体的容器倒扣在水中,通入标准状况下一定体积的O2,恰好使气体全部溶于水生成HNO3,则通入O2的体积