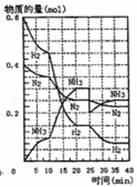
摘要:15.500℃.20Mpa时.将H2和N2置于一容积为 2L的密闭容器中发生反应.反应过程中H2.N2 和NH3物质的量变化如图所示.下列说法正确 的是 A.反应开始到第一次平衡时.N2的平均反应速 率为0.005mol/ B.从曲线变化可以看出.反应进行到10min至 20min钟时可能是使用了催化剂 C.从曲线变化可以看出.反应进行至25min钟 时.分离出0.1mol的氨气 D.在25min钟时平衡正向移动但达到新平衡后 NH3的体积分数比原平衡小
网址:http://m.1010jiajiao.com/timu3_id_41042[举报]
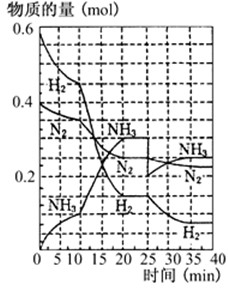 500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3物质的量变化如图所示,下列说法正确的是( )
500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3物质的量变化如图所示,下列说法正确的是( )| A、反应开始到第一次平衡时,N2的平均反应速率为0.005mol/(L?min) | B、从曲线可以看出,反应进行到10min至20min时可能是使用了催化剂 | C、从曲线可以看出,反应进行至25min时,增加了0.1mol氨气 | D、在25min平衡正向移动但达到新平衡后NH3的体积分数比原平衡小 |
500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应:3H2+N22NH3 △H<0。反应过程中H2、N2和NH3物质的量变化如右图所示,据图判断下列叙述不正确的是

A.反应开始到第一次平衡时,N2的平均反应速率为0.0625 mol·(L·min)-1 ,H2的转化率为75%
B.反应达到第一次平衡时,反应的平衡常数表达式可写作:K=c2(NH3)/[ c3(H2) ·c(N2)]=(0.15 mol·L-1) 2/[ (0.075 mol·L-1) 3 ·(0.125 mol·L-1)]
C.从曲线变化可以看出,反应进行到10min至20min时可能采取的措施是使用了催化剂
D.从曲线变化可以看出,反应进行至25min时,采取的措施是分离出0.1mol的氨气,平衡正向移动
查看习题详情和答案>>
500℃、20Mpa时,将H2和N2置于一容积为2L的密闭容器中发生反应。反应过程中H2、N2和NH3物质的量变化如图所示,下列说法正确的是
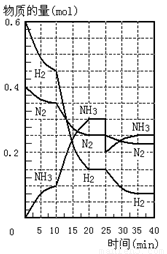
A.反应开始到第一次平衡时,N2的平均反应速率为0.005mol/(L·min)
B.从曲线变化可以看出,反应进行到10min至20min钟时可能是使用了催化剂
C.从曲线变化可以看出,反应进行至25min钟时,分离出0.2mol的氨气
D.在25min钟时平衡正向移动但达到新平衡后 NH3的体积分数比原平衡小
查看习题详情和答案>>
500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应反应过程中H2、N2和NH3物质的量变化如下图所示,下列说法正确的是
| A.反应开始到第一次平衡时,N2的平均反应速率为0.005 mol/(L·min) |
| B.从曲线可以看出,反应进行到10min至20min时可能是使用了催化剂 |
| C.从曲线可以看出,反应进行至25min时,增加了0.1mol氨气 |
| D.在25min平衡正向移动但达到新平衡后NH3的体积分数比原平衡小 |