摘要:烃A是丁烷裂解的一种产物.能发生如下变化.其中G是有机物中含氢量最大的烃. 试推断各物质的结构简式A B C D E F G
网址:http://m.1010jiajiao.com/timu3_id_410103[举报]
已知A是生活中的一种常见有机物,烃B分子内C、H原子个数比为1︰2,核磁共振
氢谱显示分子中只有一种化学环境的氢原子,D的分子式为C2H4O,各物质有如下转化关系:

请回答下列问题:
(1)A物质的官能团名称是???????? ; C的结构简式______________;
(2)D的红外光谱表明分子内除C—H键、C—C键外还含有两个C—O单键,D与HCl按物质的量之比1:l反应,原子利用率为100%,则D的结构简式是???????? ;
(3)甲苯生成甲的反应类型为????????? ;
(4)乙中有两种含氧官能团,乙与E反应的化学方程式为????????? ;
(5)普鲁卡因的一种水解产物与甲互为同分异构体,该物质的同分异构体(包含该物质)符合下列条件的有?? (填数字)种。
a.分子结构中含苯环,且每个苯环有2个侧链
b.分子结构中一定含官能团—NH2,且—NH2直接与碳原子相连
查看习题详情和答案>>
金刚烷是一种重要的化工原料,如合成的金刚烷胺就是一种抗病毒药剂,对帕金森症、老年痴呆有良好的疗效.由环戊二烯合成金刚烷的路线如下:
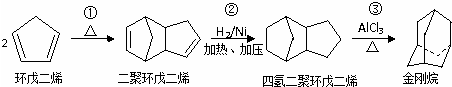
请回答下列问题:
(1)反应①的反应类型是
(2)写出环戊二烯与Br21:1在较高温度下的加成反应产物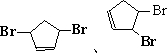
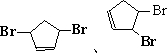 .
.
(3)金刚烷形成的二氯取代物有
(4)在有机分析中,常用臭氧氧化分解来确定有机物中碳碳双键的位置与数目.
A是金刚烷的一种同分异构体,经臭氧氧化后的产物仅为一种,其结构为 ,试写出A所有可能的结构简式
,试写出A所有可能的结构简式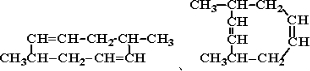
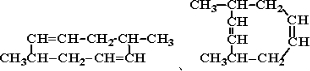 .
.
查看习题详情和答案>>

请回答下列问题:
(1)反应①的反应类型是
加成反应
加成反应
,金刚烷的分子式为C10H16
C10H16
.(2)写出环戊二烯与Br21:1在较高温度下的加成反应产物
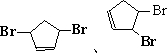
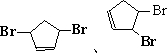
(3)金刚烷形成的二氯取代物有
2
2
种(4)在有机分析中,常用臭氧氧化分解来确定有机物中碳碳双键的位置与数目.

A是金刚烷的一种同分异构体,经臭氧氧化后的产物仅为一种,其结构为
 ,试写出A所有可能的结构简式
,试写出A所有可能的结构简式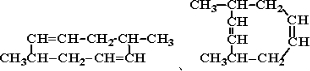
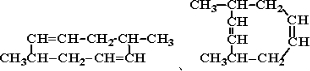
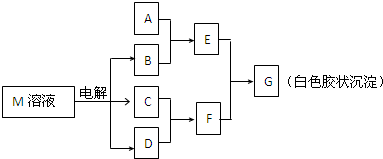
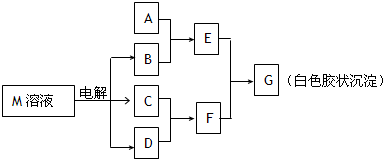
(2011?东城区模拟)已知物质M由同一短周期的X、Y两种元素组成,X原子的最外层电子数是最内层电子数的一半,Y元素最高正价与它的负价代数和为6.M与其他物质的转化关系如下(部分产物已略去):
(1)工业电解M溶液的化学方程式为
(2)若A是X、Y同周期的一种常见金属,则A元素在周期表中的位置是
(3)若A是某元素的一种常见酸性氧化物,可用于制造光导纤维,则该元素原子结构示意图为
 ,写出E与F反应的离子方程式是
,写出E与F反应的离子方程式是
(4)B的电子式为: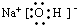
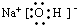 ,其中的化学键为:
,其中的化学键为:
(5)说明M物质的一种用途:
查看习题详情和答案>>

(1)工业电解M溶液的化学方程式为
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
| ||
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
.
| ||
(2)若A是X、Y同周期的一种常见金属,则A元素在周期表中的位置是
第三
第三
周期IIIA族
IIIA族
族,写出A与B溶液反应的化学方程式是2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
.(3)若A是某元素的一种常见酸性氧化物,可用于制造光导纤维,则该元素原子结构示意图为


2H++SiO32-=H2SiO3↓
2H++SiO32-=H2SiO3↓
.(4)B的电子式为:
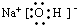
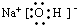
离子键和极性键
离子键和极性键
.(5)说明M物质的一种用途:
氯碱工业
氯碱工业
.化合物A是石油化工的一种重要原料,用A和水煤气为原料经下列途径合成化合物D(分子式为C3H6O3).

已知:

请回答下列问题:
(1)写出下列物质的结构简式:
A:
(2)指出反应②的反应类型
(3)写出反应③的化学方程式
(4)反应④的目的是
(5)化合物D’是D的一种同分异构体,它最早发现于酸牛奶中,是人体内糖类代谢的中间产物.D’在浓硫酸存在的条件下加热,既可以生成能使溴水褪色的化合物E(C3H4O2),又可以生成六原子环状化合物F(C6H8O4).请分别写出D’生成E和F的化学方程式:
D’→E:
D’→F:
 .
.
查看习题详情和答案>>

已知:

请回答下列问题:
(1)写出下列物质的结构简式:
A:
CH2=CH2
CH2=CH2
;B:CH3CH2CHO
CH3CH2CHO
;C:CH2=CHCHO
CH2=CHCHO
;D:CH2(OH)CH(OH)CHO
CH2(OH)CH(OH)CHO
.(2)指出反应②的反应类型
取代反应
取代反应
.(3)写出反应③的化学方程式
CH3CHBrCHO+NaOH
CH2=CHCHO+NaBr+H2O
| 醇 |
| △ |
CH3CHBrCHO+NaOH
CH2=CHCHO+NaBr+H2O
.| 醇 |
| △ |
(4)反应④的目的是
保护醛基,防止反应⑤时被高锰酸钾碱性溶液氧化
保护醛基,防止反应⑤时被高锰酸钾碱性溶液氧化
.(5)化合物D’是D的一种同分异构体,它最早发现于酸牛奶中,是人体内糖类代谢的中间产物.D’在浓硫酸存在的条件下加热,既可以生成能使溴水褪色的化合物E(C3H4O2),又可以生成六原子环状化合物F(C6H8O4).请分别写出D’生成E和F的化学方程式:
D’→E:
CH3CH(OH)COOH
CH2=CHCOOH+H2O
| 浓硫酸 |
| △ |
CH3CH(OH)COOH
CH2=CHCOOH+H2O
.| 浓硫酸 |
| △ |
D’→F:


(2011?天津模拟)已知物质M由同一短周期的X、Y两种元素组成,X原子的最外层电子数是最内层电子数的一半,Y元素最高正价与它的负价代数和为6.M与其他物质的转化关系如图(部分产物已略去):
(1)若A是与X、Y同周期的一种常见金属,则A元素在周期表中的位置是
(2)若A是某元素的一种常见酸性氧化物,可用于制造光导纤维,则该元素原子结构示意图为
 ,写出E与F反应的离子方程式
,写出E与F反应的离子方程式
(3)B的电子式为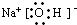
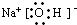 ,其中的化学键为
,其中的化学键为
 .
.
(4)工业上用电解物质M的产物之一氧化有毒含氰(CN-)碱性废水,得到无毒的N2、CO2等.写出此反应的离子反应方程式
查看习题详情和答案>>

(1)若A是与X、Y同周期的一种常见金属,则A元素在周期表中的位置是
第三
第三
周期第IIIA
第IIIA
族,写出A与B溶液反应的化学方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
.(2)若A是某元素的一种常见酸性氧化物,可用于制造光导纤维,则该元素原子结构示意图为


2H++SiO32-=H2SiO3↓
2H++SiO32-=H2SiO3↓
.(3)B的电子式为
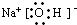
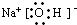
离子键和共价键
离子键和共价键
.用电子式表示M的形成过程

(4)工业上用电解物质M的产物之一氧化有毒含氰(CN-)碱性废水,得到无毒的N2、CO2等.写出此反应的离子反应方程式
5Cl2+2CN-+8OH-=10Cl-+N2+2CO2+4H2O
5Cl2+2CN-+8OH-=10Cl-+N2+2CO2+4H2O
.