网址:http://m.1010jiajiao.com/timu3_id_409232[举报]
查看习题详情和答案>>
A.实验中所用到的滴定管、容量瓶,在使用前均需要检漏;
B.如果实验中需用60mL的稀硫酸标准溶液,配制时应选用100mL容量瓶;
C.容量瓶中含有少量蒸馏水,会导致所配标准溶液的浓度偏小;
D.酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀硫酸,则测得的NaOH溶液的浓度将偏大;
E.用甲基橙作指示剂,滴定终点时,溶液颜色从橙色变为红色;
F.配制溶液和中和滴定的两个实验中,若在最后一次读数均俯视读数,则导致实验结果都偏大.
Ⅱ.现用如图1所示的装置制取较多量的饱和氯水并测定饱和氯水的pH.回答有关问题:
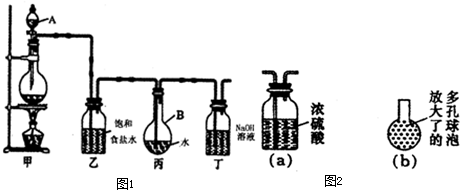
(1)写出有关化学方程式.
装置甲:
| ||
| ||
装置丁:
(2)证明氯水已饱和的现象是
(3)制取结束时,装置丙的液体中含有的微粒是
(4)有如下改进措施或建议,请作出评价:
①在装置乙和丙之间增加如图2(a)所示的装置,你认为有无必要?
②在装置丙的长导管下口处,接如图2(b)所示的多孔球泡,这样做的好处是:
③若撤去装置乙,直接将装置甲和丙相连.这样做对实验结果的影响是:
水合肼作为一种重要的精细化工原料,在农药、医药及有机合成中有广泛用途。用尿素法制备水合肼,可分为两个阶段,第一阶段为低温氯化阶段,第二阶段为高温水解阶段,总反应方程式为:(NH2)2CO +NaClO+2NaOH → H2N—NH2·H2O+NaCl+Na2CO3。
主要副反应:N2H4+2NaClO= N2↑+2H2O+2NaCl △H<0
3NaClO=" 2NaCl" +NaClO3 △H>0
CO(NH2)2 +2NaOH= 2NH3↑+Na2CO3 △H>0
【深度氧化】:(NH2)2CO+3NaClO= N2↑+3NaCl+CO2↑+2H2O △H<0
实验步骤:
步骤1.向30%的NaOH溶液中通入Cl2,保持温度在30℃以下,至溶液显浅黄绿色停止通Cl2。
步骤2.静置后取上层清液,检测NaClO的浓度。
步骤3.倾出上层清液,配制所需浓度的NaClO和NaOH的混合溶液。
步骤4.称取一定质量尿素配成溶液,置于冰水浴。将一定体积步骤3配得的溶液倒入分液漏斗中,慢慢滴加到尿素溶液中,0.5h左右滴完后,继续搅拌0.5h。
步骤5.将步骤4所得溶液,加入5g KMnO4作催化剂,转移到三口烧瓶(装置见图),边搅拌边急速升温,在108℃回流5 min。
步骤6.将回流管换成冷凝管,蒸馏,收集( 108~114℃)馏分,得产品。
(1)步骤1温度需要在30℃以下,其主要目的是 。
(2)步骤2检测NaClO浓度的目的是 。
a.确定步骤3中需NaClO溶液体积及NaOH质量
b.确定步骤4中冰水浴的温度范围
c.确定步骤4中称量尿素的质量及所取次氯酸钠溶液体积关系
d.确定步骤5所需的回流时间
(3)尿素法制备水合肼,第一阶段为反应 (选填:“放热”或“吸热”)。
(4)步骤5必须急速升温,严格控制回流时间,其目的是 。
(5)已知水合肼在碱性条件下具有还原性(如:N2H4+2I2=N2+4HI)。测定水合肼的质量分数可采用下列步骤:
a.准确称取2.000g试样,经溶解、转移、定容等步骤,配制250mL溶液。
b.移取l0.00 mL于锥形瓶中,加入20mL水,摇匀.
c.用0.l000 mol/L碘溶液滴定至溶液出现微黄色且Imin内不消失,计录消耗碘的标准液的体积。
d.进一步操作与数据处理
①滴定时,碘的标准溶液盛放在 滴定管中(选填:“酸式”或“碱式”)。
②若本次滴定消耗碘的标准溶液为18.00mL,可测算出产品中N2H4-H2O的质量分数为 。
③为获得更可靠的滴定结果,步骤d中进一步操作主要是: