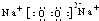题目内容
已知 Cl2+2NaOH═NaCl+NaClO+H2O,现有瓶NaOH溶液,质量分数为14%( 其密度为1.14g/ml)则这种溶液
0.05
0.05
升能与2.24升(标况下)Cl2恰好完全反应.分析:由c=
计算溶液的物质的量浓度,由标准状况下n=
来计算氯气的物质的量,然后利用化学反应方程式进行计算即可.
| 1000ρw |
| M |
| V |
| Vm |
解答:解:NaOH溶液的物质的量浓度为
=4.00mol/L,
氯气的物质的量为
=0.1mol,
设需要这种溶液的体积为V,则
Cl2+2NaOH═NaCl+NaClO+H2O,
1 2
0.1mol V×4.00mol/L
=
,解得V=0.05L,
故答案为:0.05.
| 1000×1.14g/ml×14% |
| 40 |
氯气的物质的量为
| 2.24L |
| 22.4L/mol |
设需要这种溶液的体积为V,则
Cl2+2NaOH═NaCl+NaClO+H2O,
1 2
0.1mol V×4.00mol/L
| 1 |
| 2 |
| 0.1mol |
| V×4.00mol/L |
故答案为:0.05.
点评:本题考查学生利用化学反应方程式的简单计算,明确溶液的浓度与物质的量的关系、气体体积与物质的量的关系然后代入化学反应方程式即可解答.

练习册系列答案
 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目

 阴极获得钛可能发生的反应或电极反应为:
阴极获得钛可能发生的反应或电极反应为: ,下列说法正确的是
,下列说法正确的是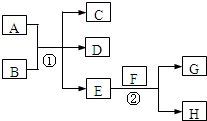 已知常温下E为无色无味的液体,F为淡黄色粉末,G为常见的无色气体(反应条件均已略),请回答下列问题:
已知常温下E为无色无味的液体,F为淡黄色粉末,G为常见的无色气体(反应条件均已略),请回答下列问题: