摘要:25.计算题 已知:工业制硝酸涉及下列重要的反应: 4NH3+5O24NO+6H2O, 4NO+3O2+2H2O4HNO3 设空气中氧气的体积分数为0.20.氮气体积分数为0.80.请完成下列填空及计算: ⑴amol NO完全转化为HNO3需要氧气的物质的量 n(O2)= mol, ⑵现有氨气和空气组成的混合气体.为使NH3和空气中的氧气恰好完全反应生成一氧化氮.则氨气和空气组成的混合气体中氨的体积分数为 ⑶硝酸工业生产中的尾气有NO 和NO2 气体.可用纯碱溶液吸收.有关的化学反应为: 2NO2 + Na2CO3 → NaNO2 + NaNO3 + CO2↑ ① NO + NO2 + Na2CO3 → 2NaNO2 + CO2↑ ② 现有1000g质量分数为21.2%的纯碱吸收液.吸收硝酸工业尾气.每产生22.4LCO2时.吸收液质量增加44g. 计算吸收液中NaNO2和NaNO3物质的量之比.
网址:http://m.1010jiajiao.com/timu3_id_409013[举报]
已知273℃、1.01×105Pa时,1mol气体所占的体积为44.8L,现将此条件下的V1 L SO2和O2混合气体通过装有催化剂的反应器,假设反应完全后,气体的体积为V2 L,所得的气体用含a mol NaOH的溶液吸收,恰好完全反应,当产物分别为下列3种情况时,计算并推导a的表达式.(用V1、V2表示)(1)Na2SO4;(2)Na2SO4和Na2SO3;(3)Na2SO4和NaHSO3。
查看习题详情和答案>>已知NH3与Cl2在常温下能迅速发生化学反应2NH3+3Cl2=N2+6HCl,若有Cl2与NH3共a L,混合后充分反应后的气体体积是b L.试讨论Cl2与NH3体积比取值范围不同时,被氧化的NH3的体积.(气体的体积均在常温、常压下测定)
查看习题详情和答案>>氨气是重要的化工原料,请回答有关氨的相关问题
(1)氨催化氧化是工业制硝酸的一步重要转化。已知:
4NH3(g)+3O2(g)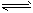 2N2(g)+6H2O(g) ΔH= -1266.8 kJ·mol-1
2N2(g)+6H2O(g) ΔH= -1266.8 kJ·mol-1
2NO(g)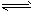 N2(g)+O2(g) ΔH= - 180.5 kJ·mol-1
N2(g)+O2(g) ΔH= - 180.5 kJ·mol-1
写出氨催化氧化4NH3+5O2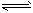 4NO+6H2O 的热化学方程式___________________
4NO+6H2O 的热化学方程式___________________
(2)氨催化氧化反应的化学平衡常数表达式为K=__________该反应在一定条件下_______(能、不能)自发反应。理由是________________________。
(3)氨溶水呈碱性,写出氨水呈碱性的离子方程式___________________将0.1 mol/L氨水和0.1 mol·L-1盐酸等体积混合,写出中和反应的离子方程式_____________反应后溶液中离子浓度由大到小依次为_________________。
(4)合成氨中,制取氢气的方法之一是:CO(g)+H2O(g)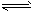 CO2(g)+H2(g) △H<0该反应在427°C时的平衡常数是9。如果反应开始时,一氧化碳和水蒸气的浓度都是0.1mol/L,计算一氧化碳的转化率。(写出计算过程)
CO2(g)+H2(g) △H<0该反应在427°C时的平衡常数是9。如果反应开始时,一氧化碳和水蒸气的浓度都是0.1mol/L,计算一氧化碳的转化率。(写出计算过程)
查看习题详情和答案>>
(1)氨催化氧化是工业制硝酸的一步重要转化。已知:
4NH3(g)+3O2(g)
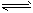 2N2(g)+6H2O(g) ΔH= -1266.8 kJ·mol-1
2N2(g)+6H2O(g) ΔH= -1266.8 kJ·mol-12NO(g)
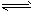 N2(g)+O2(g) ΔH= - 180.5 kJ·mol-1
N2(g)+O2(g) ΔH= - 180.5 kJ·mol-1 写出氨催化氧化4NH3+5O2
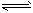 4NO+6H2O 的热化学方程式___________________
4NO+6H2O 的热化学方程式___________________ (2)氨催化氧化反应的化学平衡常数表达式为K=__________该反应在一定条件下_______(能、不能)自发反应。理由是________________________。
(3)氨溶水呈碱性,写出氨水呈碱性的离子方程式___________________将0.1 mol/L氨水和0.1 mol·L-1盐酸等体积混合,写出中和反应的离子方程式_____________反应后溶液中离子浓度由大到小依次为_________________。
(4)合成氨中,制取氢气的方法之一是:CO(g)+H2O(g)
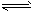 CO2(g)+H2(g) △H<0该反应在427°C时的平衡常数是9。如果反应开始时,一氧化碳和水蒸气的浓度都是0.1mol/L,计算一氧化碳的转化率。(写出计算过程)
CO2(g)+H2(g) △H<0该反应在427°C时的平衡常数是9。如果反应开始时,一氧化碳和水蒸气的浓度都是0.1mol/L,计算一氧化碳的转化率。(写出计算过程) 科学家一直致力于“人工固氮”的新方法研究.据报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3和O2.
(1)已知:①H2(g)+
O2(g)═H2O(l)△Hl=-285.6kJ/mol
②N2(g)+3H2(g)?2NH3(g)△H2=-92.2kJ/mol
写出此条件下氮气和水反应的热化学方程式 .
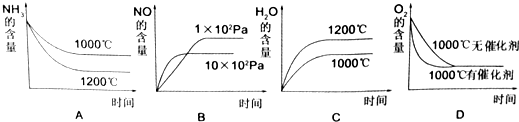
(2)氨可用于工业制硝酸,其主反应为:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H<0,此反应的化学平衡常数表达式为 ,若此反应起始的物质的量相同,则如图所示的关系图正确的是 (填序号)
在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
①反应在第2min到第4min时,O2的平均反应速率为 mol?L-1?min-1.
②反应在第2min时改变了条件,改变的条件可能是 .
③在第6min时,改变了反应的条件,该平衡向 移动(填“左”或“右”).
查看习题详情和答案>>
(1)已知:①H2(g)+
| 1 |
| 2 |
②N2(g)+3H2(g)?2NH3(g)△H2=-92.2kJ/mol
写出此条件下氮气和水反应的热化学方程式
(2)氨可用于工业制硝酸,其主反应为:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H<0,此反应的化学平衡常数表达式为

在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
| 时间/浓度 | c(NH3)(mol/L) | c(O2)(mol/L) | c(NO)(mol/L) |
| 起始 | 0.8000 | 1.600 | 0.000 |
| 第2min | 0.6000 | a | 0.2000 |
| 第4min | 0.3000 | 0.9750 | 0.5000 |
| 第6min | 0.3000 | 0.9750 | 0.5000 |
| 第8min | 0.7000 | 1.475 | 0.1000 |
②反应在第2min时改变了条件,改变的条件可能是
③在第6min时,改变了反应的条件,该平衡向
铁、铝、铜及其化合物在生产、生活中有广泛的用途,试回答下列问题:
(1)制造电路板的工艺中,FeCl3溶液可以蚀刻铜箔,请写出该反应的离子方程式 ;
(2)已知铜与稀硫酸不反应,但将铜片在稀硫酸中长时间加热时溶液会呈蓝色,请用化学方程式表示原因 .
(3)氯化铝广泛用于有机合成和石油工业的催化剂.将铝土矿粉(主要成分为Al2O3)与焦炭混合后加热并通入氯气,可得到氯化铝,同时生成CO,写出该反应的化学方程式 .
(4)已知Cu2S可以和硝酸反应,请配平下列化学反应方程式:
□Cu2S+□HNO3
□CuSO4+□Cu(NO3)2+□NO↑+□
(5)在常温下,向0.10mol?L-1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=9时,c(Cu2+)= mol?L-1(KSP[Cu(OH)2]=2.8×10-20).
(6)某校兴趣小组欲测定一种铁铝硅合金(FexAlySiz)粉末的组成,提出如下方案:准确称取1.46g该合金粉末,加入过量盐酸溶液充分反应后过滤,测定剩余固体质量0.07g.向滤液中滴加足量浓NaOH溶液,充分搅拌、过滤、洗涤得固体.再将所得固体充分加热、灼烧得红棕色粉末1.60g,通过计算确定此合金的组成为 (填化学式).
查看习题详情和答案>>
(1)制造电路板的工艺中,FeCl3溶液可以蚀刻铜箔,请写出该反应的离子方程式
(2)已知铜与稀硫酸不反应,但将铜片在稀硫酸中长时间加热时溶液会呈蓝色,请用化学方程式表示原因
(3)氯化铝广泛用于有机合成和石油工业的催化剂.将铝土矿粉(主要成分为Al2O3)与焦炭混合后加热并通入氯气,可得到氯化铝,同时生成CO,写出该反应的化学方程式
(4)已知Cu2S可以和硝酸反应,请配平下列化学反应方程式:
□Cu2S+□HNO3
| ||
(5)在常温下,向0.10mol?L-1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=9时,c(Cu2+)=
(6)某校兴趣小组欲测定一种铁铝硅合金(FexAlySiz)粉末的组成,提出如下方案:准确称取1.46g该合金粉末,加入过量盐酸溶液充分反应后过滤,测定剩余固体质量0.07g.向滤液中滴加足量浓NaOH溶液,充分搅拌、过滤、洗涤得固体.再将所得固体充分加热、灼烧得红棕色粉末1.60g,通过计算确定此合金的组成为