摘要:可不写推算过程.其余均需写出推算过程) 某天然碱可看作由CO2和NaOH反应后的产物组成.现称取不同质量的天然碱样品四份溶于水后分别逐滴加入同浓度的盐酸50ml.产生CO2的体积 I II III IV 盐酸溶液的体积/ml 50 50 50 50 样品质量/g 3.32 4.15 5.81 CO2的体积/ml 672 840 896 672 请回答:(1)由上表已知数据推测:第 组实验中盐酸不足原因是 (2)由第 组数据可推测2.22g样品进行同样实验时产生CO2 ml (3)另取3.32g样品于300℃加热至质量不变为止.(Na2CO3在300℃时不分解)产生CO2112ml 和H2O0.45g.计算并确定该天然碱的化学式. (4)已知Na2CO3和盐酸的反应分两步进行由表中第 组已知数据可以确定所用盐酸的浓度.其浓度为多少? (5)表中四组CO2的体积有无最大值.若无清推算当样品质量为多少时.加入该盐酸产生的CO2体积最大.最大体积为多少毫升? (6)请推算出第II组数据中所缺样品的质量. (7)依据上表所列数据及所计算出的其它数据以及天然碱的化学式.讨论并确定上述实验中CO2的体积与样品质量之间的关系式.
网址:http://m.1010jiajiao.com/timu3_id_408971[举报]

上述转化关系中除②③⑤外,其余均在溶液中进行,且部分反应物、生成物均被略去.已知X、Y为非金属单质,X为黄色粉末,Z为常见金属,F、G、Y为气体,D是一种酸,H为蓝色絮状沉淀,I为深蓝色晶体.工业上常利用反应②炼制Z,利用反应③④制备A,一定量C经反应②③完全得到E时,质量不变.A、D、I溶液滴加BaCl2溶液均产生白色沉淀,B的焰色反应呈黄色.试填空:
(1)写出C、I的化学式
Cu2S
Cu2S
、:[Cu(NH3)4]SO4?H2O
:[Cu(NH3)4]SO4?H2O
;(2)用电子式表示G的形成过程
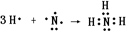
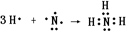
(3)用惰性电极电解A溶液的离子方程式为
2Cu2++2H2O
2 Cu+O2↑+4H+
| ||
2Cu2++2H2O
2 Cu+O2↑+4H+
;反应⑥的离子方程式为
| ||
S2O32-+2H+═S↓+SO2↑+H2O
S2O32-+2H+═S↓+SO2↑+H2O
;(4)F气体具有漂白性,其漂白原理为
SO2可与有机色素分子化合生成无色不稳定物质
SO2可与有机色素分子化合生成无色不稳定物质
.在探索生命奥秘的过程中,科学家们日益认识到生命细胞的组成和元素周期律有着密切的关系,约占人体总质量99.97%的11种宏量元素,全部位于元素周期表中前20号元素之内,其余0.03%是由十多种人体不可缺少的微量元素组成.在微量元素中,只有F和Si位于短周期,其余均属第一长周期.在宏量元素中,除H、N、P外,在现用的周期表里还有的元素是:(写元素符号)
(1)原子最外层电子数是次外层电子数2倍的是
(2)最高价氧化物对应水化物酸性最强的元素是
(3)原子半径最大的元素是
(4)剩余的两种元素,它们的离子电子层结构均与Ne的相同,且带电量也相同,但符号相反的两种元素是
查看习题详情和答案>>
(1)原子最外层电子数是次外层电子数2倍的是
C
C
;(2)最高价氧化物对应水化物酸性最强的元素是
Cl
Cl
,跟它处在同一周期的还有一种非金属元素是S
S
;(3)原子半径最大的元素是
K
K
,跟它相邻的两种元素是Na、Ca
Na、Ca
;(4)剩余的两种元素,它们的离子电子层结构均与Ne的相同,且带电量也相同,但符号相反的两种元素是
Mg
Mg
和O
O
.铁氧体是一类磁性材料,通式为MO?xFe2O3(M为二价金属离子).
根据题意完成:
Ⅰ、为了制备铁氧体,称取5.6g铁粉、一定量的FeCl3(s) 作为原料,先制备Fe3O4.方法如下:用稀硫酸溶解铁粉,加入FeCl3(s),经过一系列反应得到纯净的Fe3O4[已知1molFe(OH)2与2molFe(OH)3混合灼烧可得到1mol Fe3O4].需要加入FeCl3(s)
Ⅱ、如果以MgSO4(s)和FeCl3(s)为原料制备9.0g MgO?2Fe2O3,在制取过程中至少需要1mol/L的NaOH(aq)
Ⅲ、在一次制备Fe3O4的实验中,由于反应物比例控制不当,获得了另一种产品.取a克该产品溶于100mL盐酸(足量)中,需要通入672mL(标准状况)Cl2才能把溶液中的Fe2+全部氧化为Fe3+,然后蒸干所得溶液,灼烧至恒重,得9.6g固体.计算:
①ag该产品溶于盐酸后,溶液中Fe2+的物质的量浓度(溶液体积变化忽略不计).
②推算该产品的化学式(写出推算过程).
Ⅳ、有一种在电子工业广泛应用的含铬铁氧体,其组成可表示为:Fe2+?Fe3+[Fe3+(1-x)?Cr3+x?O4].向含有1.92mol硝酸的某溶液中加入一定量的该种铁氧体,恰好完全反应后,收集到NO、NO2的混合气体2.688L(标准状况).计算:(均需写出计算过程)
①参加反应的铁氧体的物质的量.
②所得气体中NO、NO2的体积比.
查看习题详情和答案>>
根据题意完成:
Ⅰ、为了制备铁氧体,称取5.6g铁粉、一定量的FeCl3(s) 作为原料,先制备Fe3O4.方法如下:用稀硫酸溶解铁粉,加入FeCl3(s),经过一系列反应得到纯净的Fe3O4[已知1molFe(OH)2与2molFe(OH)3混合灼烧可得到1mol Fe3O4].需要加入FeCl3(s)
32.5
32.5
g.Ⅱ、如果以MgSO4(s)和FeCl3(s)为原料制备9.0g MgO?2Fe2O3,在制取过程中至少需要1mol/L的NaOH(aq)
350
350
mL.Ⅲ、在一次制备Fe3O4的实验中,由于反应物比例控制不当,获得了另一种产品.取a克该产品溶于100mL盐酸(足量)中,需要通入672mL(标准状况)Cl2才能把溶液中的Fe2+全部氧化为Fe3+,然后蒸干所得溶液,灼烧至恒重,得9.6g固体.计算:
①ag该产品溶于盐酸后,溶液中Fe2+的物质的量浓度(溶液体积变化忽略不计).
②推算该产品的化学式(写出推算过程).
Ⅳ、有一种在电子工业广泛应用的含铬铁氧体,其组成可表示为:Fe2+?Fe3+[Fe3+(1-x)?Cr3+x?O4].向含有1.92mol硝酸的某溶液中加入一定量的该种铁氧体,恰好完全反应后,收集到NO、NO2的混合气体2.688L(标准状况).计算:(均需写出计算过程)
①参加反应的铁氧体的物质的量.
②所得气体中NO、NO2的体积比.
如图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出.常温下X是固体,B和G是液体,其余均为气体,F是红棕色气体.根据如图关系推断:

(1)化学式:X
(2)写出C-→E的化学反应方程式
(3)请写出F与B反应生成G的化学方程式:
查看习题详情和答案>>

(1)化学式:X
(NH4)2CO3 或者 NH4HCO3
(NH4)2CO3 或者 NH4HCO3
.(2)写出C-→E的化学反应方程式
2CO2+2Na2O2═2Na2CO3+O2
2CO2+2Na2O2═2Na2CO3+O2
(3)请写出F与B反应生成G的化学方程式:
3NO2+H2O═2HNO3+NO
3NO2+H2O═2HNO3+NO
,该反应过程中氧化产物和还原产物的物质的量之比为2:1
2:1
.A、B、C、D是四种常见单质,其对应元素的原子序数依次增大,其中B、D属于常见金属,其余均为常见化合物,J是一种黑色固体,I的浓溶液具有还原性,从A-I的所有物质之间有如下的转化关系: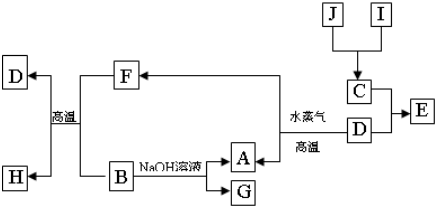
回答下列问题:
(1)写出物质C的构成元素在周期表中的位置
(2)写出B与F反应的化学方程式
(3)由E的饱和溶液可以制得胶体,具体制备方法是:
a.光束通过该液体时形成光亮的“通路”?
b.向液体中逐滴加入足量氢碘酸,先有沉淀产生,后沉淀逐渐溶解,再滴入几滴淀粉溶液,溶液变为蓝色
c.向该液体中加入硝酸银溶液,无沉淀产生?
d.将该液体加热、蒸干、灼烧,得红棕色固体?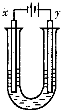
另取少量上述胶体置于U型管中,按如图装置图连接好装置.通电一小段时间后,X极附近的现象是
(4)取少量上述胶体置于试管中,向试管中滴加一定量稀盐酸,边滴边振荡,可以看到溶液颜色逐渐变浅,最终得到黄色的溶液,发生此变化的离子方程式为
(5)G的水溶液显
(6)J在H2O2分解反应中作催化剂.若将适量J加入酸化的H2O2的溶液中,J溶解生成它的+2价离子,该反应的离子方程式是
查看习题详情和答案>>

回答下列问题:
(1)写出物质C的构成元素在周期表中的位置
第三周期、第ⅦA族
第三周期、第ⅦA族
.(2)写出B与F反应的化学方程式
8Al+3Fe3O4
9Fe+4Al2O3
| ||
8Al+3Fe3O4
9Fe+4Al2O3
.
| ||
(3)由E的饱和溶液可以制得胶体,具体制备方法是:
将饱和FeCl3溶液逐滴加入沸水中,继续加热至液体变为红褐色
将饱和FeCl3溶液逐滴加入沸水中,继续加热至液体变为红褐色
,用化学方程式表示该过程的原理:Fe3++3H2O
Fe(OH)3(胶体)+3H+
| ||
Fe3++3H2O
Fe(OH)3(胶体)+3H+
.若要提纯该胶体,采用的操作方法叫
| ||
渗析
渗析
.此液体具有的性质是abd
abd
(填写序号字母)a.光束通过该液体时形成光亮的“通路”?
b.向液体中逐滴加入足量氢碘酸,先有沉淀产生,后沉淀逐渐溶解,再滴入几滴淀粉溶液,溶液变为蓝色
c.向该液体中加入硝酸银溶液,无沉淀产生?
d.将该液体加热、蒸干、灼烧,得红棕色固体?

另取少量上述胶体置于U型管中,按如图装置图连接好装置.通电一小段时间后,X极附近的现象是
红褐色加深
红褐色加深
.(4)取少量上述胶体置于试管中,向试管中滴加一定量稀盐酸,边滴边振荡,可以看到溶液颜色逐渐变浅,最终得到黄色的溶液,发生此变化的离子方程式为
Fe(OH)3+3H+=Fe3++3H2O
Fe(OH)3+3H+=Fe3++3H2O
.(5)G的水溶液显
碱
碱
性(填酸或碱);原因是(用离子方程式表 示)AlO2-+2H2O Al(OH)3+OH-
Al(OH)3+OH-
 Al(OH)3+OH-
Al(OH)3+OH-AlO2-+2H2O Al(OH)3+OH-
Al(OH)3+OH-
. Al(OH)3+OH-
Al(OH)3+OH-(6)J在H2O2分解反应中作催化剂.若将适量J加入酸化的H2O2的溶液中,J溶解生成它的+2价离子,该反应的离子方程式是
MnO2+H2O2+2H+═Mn2++O2↑+2H2O
MnO2+H2O2+2H+═Mn2++O2↑+2H2O
.