摘要:分析下表数据.推断下列说法正确的是 烷 烃 乙烷 丙烷 丁烷 戊烷 燃烧热 (kJ·mol-1) 1559.8 2219.9 2877.0 3536.2 沸点(℃) -88.6 -42.1 -0.5 36.1 熔点(℃) -183.3 -189.7 -138.4 -129.7 A.已烷的燃烧热约为4196 kJ·mol-1 B.乙烷燃烧的热化学方程式为2C2H6(g)+7O2(g)===4CO2(g)+6H2O(g), =-1559.8 kJ·mol-1 C.相同质量的烷烃.碳的质量分数越大.燃烧放出的热量越多 D.从上表可以分析得.丁烷气体最不适宜作气体打火机的有机燃料
网址:http://m.1010jiajiao.com/timu3_id_408958[举报]
把N2和H2按1:1(物质的量之比)混合均匀后分成四等份,分别充入A、B、C、D四个装有铁触媒的真空密闭容器中(容积不变),在保持相同温度的条件下,四个容器相继达到化学平衡状态,分析下表数据,回答下列问题:
容器代号 | A | B | C | D |
平衡时混合物平均式量 |
|
| 16 | 17 |
平衡时N2的转化率 | 20% |
|
|
|
平衡时H2的转化率 |
| 30% |
|
|
(1)平衡时,______________容器中NH3所占的比例最大。
(2)达到平衡时反应速率最小的容器是___________。
(3)四个容器的压强自小到大的排列次序是______________。
查看习题详情和答案>>控制变量法是化学实验中的一种常用方法,下表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据(计算结果精确到小数点后一位):
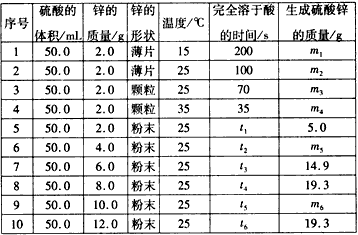
分析上表数据,回答下列问题:
(1)实验1和实验2表明__________ 对反应速率有影响,对这一规律进行研究的实验还有一组是________(填实验序号)。
(2)下列数据推断正确的是_________。
A.t1<70
B.ml< m2
C.m6=19. 3
D.t1>t4
(3)本实验还可以研究____________对化学反应速率的影响。
(4)硫酸的物质的量浓度是____mol/L,实验6生成的硫酸锌的质量m5=_________。
查看习题详情和答案>>
(1)实验1和实验2表明__________ 对反应速率有影响,对这一规律进行研究的实验还有一组是________(填实验序号)。
(2)下列数据推断正确的是_________。
A.t1<70
B.ml< m2
C.m6=19. 3
D.t1>t4
(3)本实验还可以研究____________对化学反应速率的影响。
(4)硫酸的物质的量浓度是____mol/L,实验6生成的硫酸锌的质量m5=_________。
水是生命之源,它与我们的生活密切相关.在化学实验和科学研究中,水也是一种常用的试剂.请回答下列问题:
(1)水分子中氧原子在基态时核外电子排布式为 ;
(2)H2O分子中氧原子采取的是 杂化.写出与H2O分子互为等电子体的微粒 .(写一个即可)
(3)水分子容易得到一个H+形成水合氢离子(H3O+).对上述过程的下列描述不合理的是 .
A.氧原子的杂化类型发生了改变 B.微粒的形状发生了改变
C.水分子仍保留它的化学性质 D.微粒中的键角发生了改变
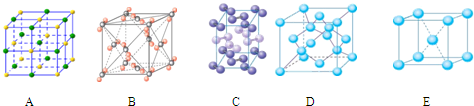
(4)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序).与冰的晶体
类型相同的是 (请用相应的编号填写)
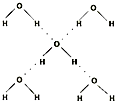
(5)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51kJ/mol,除氢键外,水分子间还存在范德华力(11kJ/mol),则冰晶体中氢键的“键能”是 kJ/mol;
(6)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子.请写出生成此配合离子的离子方程式: .
(7)已知下列元素的电负性数据:H:2.1,O:3.5,F:4.0.OF2与水的立体结构相似,但水分子的极性比OF2强得多,其原因有:①OF2中氧原子上有两对孤对电子,抵消了F一O键中共用电子对偏向F而产生的极性;②从电负性上看,
(8)分析下表数据,请写出你的最具概括性的结论:
① ;② .
查看习题详情和答案>>
(1)水分子中氧原子在基态时核外电子排布式为
(2)H2O分子中氧原子采取的是
(3)水分子容易得到一个H+形成水合氢离子(H3O+).对上述过程的下列描述不合理的是
A.氧原子的杂化类型发生了改变 B.微粒的形状发生了改变
C.水分子仍保留它的化学性质 D.微粒中的键角发生了改变
(4)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序).与冰的晶体
类型相同的是


(5)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51kJ/mol,除氢键外,水分子间还存在范德华力(11kJ/mol),则冰晶体中氢键的“键能”是
(6)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子.请写出生成此配合离子的离子方程式:
(7)已知下列元素的电负性数据:H:2.1,O:3.5,F:4.0.OF2与水的立体结构相似,但水分子的极性比OF2强得多,其原因有:①OF2中氧原子上有两对孤对电子,抵消了F一O键中共用电子对偏向F而产生的极性;②从电负性上看,
(8)分析下表数据,请写出你的最具概括性的结论:
| 键型 | 键能 (kJ/mol) |
键长 (pm) |
分子 | 键角 | 物质 | 熔点(℃) | 沸点(℃) |
| H-C | 413 | 109 | 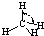 |
109.5° | 甲烷 | -183.7 | -128.0 |
| H-N | 391 | 101 | 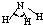 |
107° | 氨 | -77.7 | -33.3 |
| H-O | 467 | 96 | 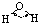 |
104.5° | 水 | 0.0 | 100.0 |
TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。某学习小组同学在实验室用钛铁矿精矿(主要成分为FeTiO3及少量SiO2等杂质)模拟工业生产TiO2, 设计流程如下
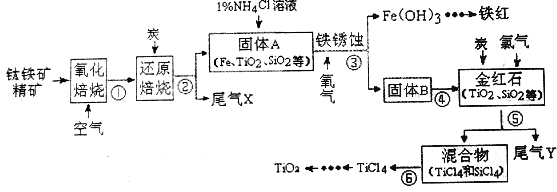
回答下列问题:
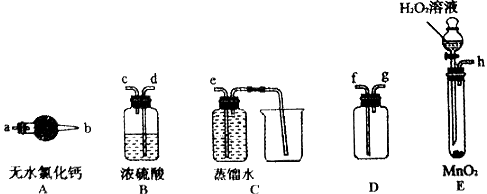
(1)选择必要的装置制备并收集干燥、纯净的氧气,按气流方向装置的正确连接顺序为_________________ (填仪器接口的字母编号);检查装置E气密性的操作过程为___________。
(1)选择必要的装置制备并收集干燥、纯净的氧气,按气流方向装置的正确连接顺序为_________________ (填仪器接口的字母编号);检查装置E气密性的操作过程为___________。
(2)步骤③铁发生电化学腐蚀的过程中,O2除参与电极反应外,还参与另外一个化学反应,该反应的化学方程式为_________________
(3)步级④中固体B经过洗涤得到金红石,验证金红石Cl–己洗净的实验方法是____________
(4)步骤⑤中产生的尾气Y中含有少量Cl2会污染环境,下列可用于吸收Cl2的试剂为_______(填字母序号) .
a.饱和食盐水 b.浓硫酸 c.浓NaOH溶液 d.石灰乳
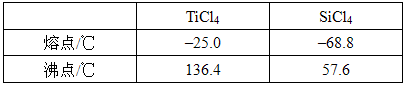
(5)分析下表数据,步骤⑥中分离TiCl4和SiCl4混合物的操作名称为_______,所用到的主要玻璃仪器除酒精灯、温度计外还有________________。
(3)步级④中固体B经过洗涤得到金红石,验证金红石Cl–己洗净的实验方法是____________
(4)步骤⑤中产生的尾气Y中含有少量Cl2会污染环境,下列可用于吸收Cl2的试剂为_______(填字母序号) .
a.饱和食盐水 b.浓硫酸 c.浓NaOH溶液 d.石灰乳
(5)分析下表数据,步骤⑥中分离TiCl4和SiCl4混合物的操作名称为_______,所用到的主要玻璃仪器除酒精灯、温度计外还有________________。