网址:http://m.1010jiajiao.com/timu3_id_408620[举报]
铁是最常见的金属之一,铁可以形成多种氧化物、氢氧化物和盐类。铁与二氧化碳、水在某一密闭体系中反应情况如下表所示:
|
化学反应 |
平衡 常数 |
温度 |
|
|
973K |
1173K |
||
|
①Fe(s)+CO2(g) |
K1 |
1.47 |
2.15 |
|
②Fe(s)+H2O(g) |
K2 |
2.38 |
1.67 |
|
③CO(g)+ H2O(g)
|
K3 |
? |
? |
完成下列填空:
(1)反应①是 (选填“吸热”,“放热”)反应。根据反应①与②可以推导出同温下K1、K2与K3之间的关系,则K3= (用K1、K2表示)。
(2)973K时,若反应③在一个容积为2L的反应容器内2min时达到平衡,有3mol电子发生转移,则在2min内v(CO2)= 。若压缩容器的容积为原来的一半,平衡将 移动(选填“向左”,“向右”,“不”),CO2的浓度将 (选填“增大”,“减小”,“不变”)。使该反应的平衡转化率及平衡常数都增大的措施有 。
(3)在FeCl3稀溶液中滴加KSCN溶液后呈红色,反应的离子方程式是 ;若在其中加入少量KCl固体,溶液的颜色________(选填“变深”,“变浅”,“不变”)。
(4)若先往FeCl3溶液中加入足量NaF溶液,再滴加KSCN溶液,则不呈红色,若再加入足够量FeCl3溶液.又会呈现红色。请对上述实验现象作出解释 。
查看习题详情和答案>>
铁是最常见的金属之一,铁可以形成多种氧化物、氢氧化物和盐类。铁与二氧化碳、水在某一密闭体系中反应情况如下表所示:
| 化学反应 | 平衡 常数 | 温度 | |
| 973K | 1173K | ||
①Fe(s)+CO2(g) 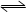 FeO(s)+CO(g) FeO(s)+CO(g) | K1 | 1.47 | 2.15 |
②Fe(s)+H2O(g) 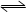 FeO(s)+H2(g) FeO(s)+H2(g) | K2 | 2.38 | 1.67 |
③CO(g)+ H2O(g) 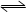 CO2(g)+ H2(g) CO2(g)+ H2(g) | K3 | ? | ? |
(1)反应①是 (选填“吸热”,“放热”)反应。根据反应①与②可以推导出同温下K1、K2与K3之间的关系,则K3= (用K1、K2表示)。
(2)973K时,若反应③在一个容积为2L的反应容器内2min时达到平衡,有3mol电子发生转移,则在2min内v(CO2)= 。若压缩容器的容积为原来的一半,平衡将 移动(选填“向左”,“向右”,“不”),CO2的浓度将 (选填“增大”,“减小”,“不变”)。使该反应的平衡转化率及平衡常数都增大的措施有 。
(3)在FeCl3稀溶液中滴加KSCN溶液后呈红色,反应的离子方程式是 ;若在其中加入少量KCl固体,溶液的颜色________(选填“变深”,“变浅”,“不变”)。
(4)若先往FeCl3溶液中加入足量NaF溶液,再滴加KSCN溶液,则不呈红色,若再加入足够量FeCl3溶液.又会呈现红色。请对上述实验现象作出解释 。 查看习题详情和答案>>
| 化学反应 | 平衡 常数 | 温度 | |
| 973K | 1173K | ||
①Fe(s)+CO2(g) 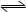 FeO(s)+CO(g) FeO(s)+CO(g) | K1 | 1.47 | 2.15 |
②Fe(s)+H2O(g) 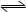 FeO(s)+H2(g) FeO(s)+H2(g) | K2 | 2.38 | 1.67 |
③CO(g)+ H2O(g) 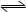 CO2(g)+ H2(g) CO2(g)+ H2(g) | K3 | ? | ? |
(1)反应①是 (选填“吸热”,“放热”)反应。根据反应①与②可以推导出同温下K1、K2与K3之间的关系,则K3= (用K1、K2表示)。
(2)973K时,若反应③在一个容积为2L的反应容器内2min时达到平衡,有3mol电子发生转移,则在2min内v(CO2)= 。若压缩容器的容积为原来的一半,平衡将 移动(选填“向左”,“向右”,“不”),CO2的浓度将 (选填“增大”,“减小”,“不变”)。使该反应的平衡转化率及平衡常数都增大的措施有 。
(3)在FeCl3稀溶液中滴加KSCN溶液后呈红色,反应的离子方程式是 ;若在其中加入少量KCl固体,溶液的颜色________(选填“变深”,“变浅”,“不变”)。
(4)若先往FeCl3溶液中加入足量NaF溶液,再滴加KSCN溶液,则不呈红色,若再加入足够量FeCl3溶液.又会呈现红色。请对上述实验现象作出解释 。
Ⅰ.同学甲选用下图所示仪器制备少量无水FeCl3,仪器连接顺序正确的是a→e→d→ → → → → 。
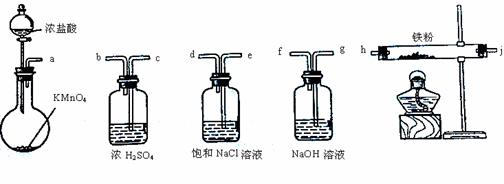
Ⅱ.同学乙善于利用类比的方法学习,他根据已知资料:硝酸能把铁氧化成Fe(NO3)3,但当铁过量时,产物是Fe(NO3)2。提出一个相似的观点:氯气与铁粉反应,当C12足量时生成FeC13,当铁粉过量时产物是FeCl2。为验证该观点是否正确,他将一根细的纯铁丝分别在足量和少量的C12中点燃,取其表面生成物并分别编号为A、B,然后通过实验确定其成分。探究过程如下:
(1)提出假设:A是FeCl3;B是FeCl2。
(2)设计实验方案:分别取A、B的溶液均进行以下实验。请填写下表中的相应空格。
| 实验方法 | 实验现象 | 结论 |
| 分别向A、B溶液中加KSCN溶液 |
| 固体物质中含有FeC13 |
| 分别向KMnO4溶液中加入适量A、B溶液 | KMnO4溶液颜色无明显变化 | 固体物质中不含 |
(3)根据上述实验结论,写出C12与铁粉加热时发生反应的化学方程式:
_________________________________________________________________;
(4)实际应用:FeCl3溶液常作印刷电路铜板腐蚀剂,腐蚀后的废液中含有FeC13、FeCl2、CuCl2,同学们设计了从废液中回收Cu的方案:向废液中加入过量的铁粉,充分反应后,过滤。在所得滤渣中加入足量的盐酸,充分反后,再过滤即得到铜。该方案涉及的四种阳离子的氧化性由强到弱的顺序为:______________________________;请写出该方案涉及的反应的离子方程式:
______________________________________。
查看习题详情和答案>>
已知有机物A~I之间的转化关系如图所示:
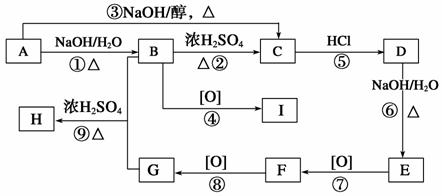
①A与D、B与E、I与F互为同分异构体;
②加热条件下将新制Cu(OH)2悬浊液分别加入到有机物I、F中,I中无明显现象,F中有砖红色沉淀生成;
③C的最简式与乙炔相同,C为芳香族化合物且相对分子质量为104;
④B的一种同分异构体与FeCl3发生显色反应。
根据以上信息,回答下列问题:
(1)C中含有的官能团名称为 。
(2)H的结构简式为 。
(3)反应①~⑨中属于取代反应的是______________________________________。
(4)写出反应⑥的化学方程式______________________________________。
(5)写出F与新制Cu(OH)2悬浊液反应的化学方程式_________________________。
(6)苯环上含有两个取代基且能与NaOH溶液反应,但不与FeCl3发生显色反应的G的同分异构体有 种。
查看习题详情和答案>> FeO(s)+CO(g)
FeO(s)+CO(g)