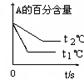
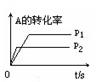
题目内容
铁是最常见的金属之一,铁可以形成多种氧化物、氢氧化物和盐类。铁与二氧化碳、水在某一密闭体系中反应情况如下表所示:
| 化学反应 | 平衡 常数 | 温度 | |
| 973K | 1173K | ||
①Fe(s)+CO2(g) 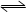 FeO(s)+CO(g) FeO(s)+CO(g) | K1 | 1.47 | 2.15 |
②Fe(s)+H2O(g) 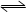 FeO(s)+H2(g) FeO(s)+H2(g) | K2 | 2.38 | 1.67 |
③CO(g)+ H2O(g) 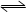 CO2(g)+ H2(g) CO2(g)+ H2(g) | K3 | ? | ? |
(1)反应①是 (选填“吸热”,“放热”)反应。根据反应①与②可以推导出同温下K1、K2与K3之间的关系,则K3= (用K1、K2表示)。
(2)973K时,若反应③在一个容积为2L的反应容器内2min时达到平衡,有3mol电子发生转移,则在2min内v(CO2)= 。若压缩容器的容积为原来的一半,平衡将 移动(选填“向左”,“向右”,“不”),CO2的浓度将 (选填“增大”,“减小”,“不变”)。使该反应的平衡转化率及平衡常数都增大的措施有 。
(3)在FeCl3稀溶液中滴加KSCN溶液后呈红色,反应的离子方程式是 ;若在其中加入少量KCl固体,溶液的颜色________(选填“变深”,“变浅”,“不变”)。
(4)若先往FeCl3溶液中加入足量NaF溶液,再滴加KSCN溶液,则不呈红色,若再加入足够量FeCl3溶液.又会呈现红色。请对上述实验现象作出解释 。
(1)吸热。K2/K1(2分)
(2)0.375 mol·(L·s)-1 。不,增大。升温。
(3)Fe3++3SCN-→Fe(SCN)3 ;(2分)不变。
(4)F-与Fe3+反应生成更为稳定的无色FeF63-。当再加入足量的FeCl3溶液时,溶液又呈血红色,说明SCN-没有被消耗。(2分)
解析试题分析:(1)温度升高,该反应平衡常数变大,反应正向进行,正反应为吸热反应;方程式①-②=③,所以K3=K2/K1;
(2)CO(g)+ H2O(g) 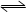 CO2(g)+ H2(g),反应中每1molCO参与反应,转移电子数为2mol,故有3mol电子发生转移有1.5mol CO反应生成1.5mol CO2,v(CO2)=1.5÷2÷2=0.375 mol·(L·s)-1;若压缩容器的容积为原来的一半,即为增大反应气体的压强,该反应反应前后气体体积不变,平衡不移动;体积减小,反应物和生成物浓度均增大,根据表中数据计算两种温度下K3,确定该反应为吸热反应,升高温度,平衡正向进行且反应速率加快;
CO2(g)+ H2(g),反应中每1molCO参与反应,转移电子数为2mol,故有3mol电子发生转移有1.5mol CO反应生成1.5mol CO2,v(CO2)=1.5÷2÷2=0.375 mol·(L·s)-1;若压缩容器的容积为原来的一半,即为增大反应气体的压强,该反应反应前后气体体积不变,平衡不移动;体积减小,反应物和生成物浓度均增大,根据表中数据计算两种温度下K3,确定该反应为吸热反应,升高温度,平衡正向进行且反应速率加快;
(4)若先往FeCl3溶液中加入足量NaF溶液,再滴加KSCN溶液,则不呈红色,说明溶液中没有Fe3+,即F-与Fe3+反应生成更为稳定的无色FeF63-,当再加入足量的FeCl3溶液时,溶液又呈血红色,说明SCN-没有被消耗。
考点:考查化学平衡、水解平衡等平衡原理有关问题。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g) FeO(s)+CO(g)△H>0,1100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示。
FeO(s)+CO(g)△H>0,1100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示。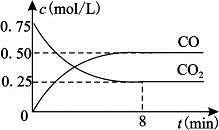
(1)下列措施中能使平衡时K增大的是___________(填序号);
A.升高温度 B.增大压强C.充入一定量COD.降低温度
(2)8分钟内,CO的平均反应速率v(CO)=___________mol/(L·min);
(3)1100℃时,2L的密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下
| 容器 | 甲 | 乙 |
| 反应物投入量 | 3molFe、2molCO2 | 4molFeO、3molCO |
| CO的浓度(mol/L) | C1 | C2 |
| CO2的体积分数 |  | 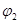 |
| 体系压强(Pa) | P1 | P2 |
| 气态反应物的转化率 | 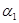 | 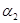 |
A.
 B.
B.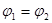 C.P1<P2D.
C.P1<P2D.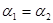
②求
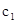 =___________、
=___________、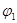 =___________、
=___________、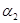 =___________。
=___________。 氮气与氢气反应生成氨气的平衡常数见下表:
| | N2+3H2 2NH3 2NH3 | |||
| 温度 | 25℃ | 200℃ | 400℃ | 600℃ |
| 平衡常数K | 5×108 | 650 | 0.507 | 0.01 |
(1)工业上合成氨的温度一般控制在500℃,原因是 。
(2)在2 L密闭容器中加入1 mol氮气和3 mol氢气,进行工业合成氨的模拟实验,若2分钟后,容器内压强为原来的0.8倍,则0到2分钟,氨气的反应速率为________mol/(L·min)。
(3)下列说法能表明该反应达到平衡的是________
A.气体的平均分子量不再变化 B.密闭容器内的压强不再变化
C.v (N2) =" 2" v (NH3) D.气体的密度不再变化
(4)下列措施,既能加快该反应的反应速率,又能增大转化率的是______________
A.使用催化剂 B.缩小容器体积 C.提高反应温度 D.移走NH3
(5)常温下,在氨水中加入一定量的氯化铵晶体,下列说法错误的是______。
A.溶液的pH增大 B.氨水的电离度减小 C.c(OH-)减小 D.c(NH4+)减小
(6)将氨水与盐酸等浓度等体积混合,下列做法能使c(NH4+)与c(Cl-)比值变大的是________
A. 加入固体氯化铵 B.通入少量氯化氢
C. 降低溶液温度 D.加入少量固体氢氧化钠
Ⅰ.(4分)在一体积为10L密闭的容器中,通入一定量的CO和H2O(g),在850℃时发生如下反应:CO(g)+H2O(g)  CO2(g)+H2(g) △H<0
CO2(g)+H2(g) △H<0
(1)CO和H2O浓度变化如图,则0~4 min的平均反应速率ν(CO)=_______ mol/(L·min),此时该反应的平衡常数为 。 
(2)当下列哪些物理量不再发生变化时,表明上述反应已达到平衡状态的是 。
| A.混合气体的压强 |
| B.混合气体的密度 |
| C.CO的物质的量浓度 |
| D.密闭容器中放出热量 |
Ⅱ.(6分)亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下。
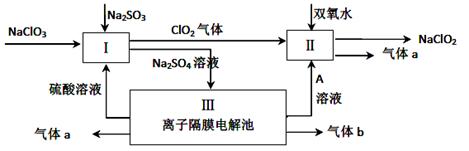
(3)配平Ⅰ中反应方程式 ClO3-+ H++ SO32-== ClO2↑+ SO42-+
(4)A的化学式是 ,。生成气体a的电极反应式 。
 CaSO4·2H2O(s)+2 OH-
CaSO4·2H2O(s)+2 OH-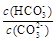 减小
减小 C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图。
C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图。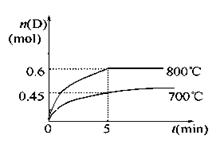
 2C(g)
2C(g)  H=" -a" kJ/mol(a>0),在一个有催化剂的固定容积的密闭容器中加入2molA2和1molB2,在500℃是充分反应达到平衡后C的浓度为w mol/L,放出热量b kJ。
H=" -a" kJ/mol(a>0),在一个有催化剂的固定容积的密闭容器中加入2molA2和1molB2,在500℃是充分反应达到平衡后C的浓度为w mol/L,放出热量b kJ。 pC(g)+ qD(g);根据下图示回答:
pC(g)+ qD(g);根据下图示回答: