题目内容
铁是最常见的金属之一,铁可以形成多种氧化物、氢氧化物和盐类。铁与二氧化碳、水在某一密闭体系中反应情况如下表所示:
|
化学反应 |
平衡 常数 |
温度 |
|
|
973K |
1173K |
||
|
①Fe(s)+CO2(g) |
K1 |
1.47 |
2.15 |
|
②Fe(s)+H2O(g) |
K2 |
2.38 |
1.67 |
|
③CO(g)+ H2O(g)
|
K3 |
? |
? |
完成下列填空:
(1)反应①是 (选填“吸热”,“放热”)反应。根据反应①与②可以推导出同温下K1、K2与K3之间的关系,则K3= (用K1、K2表示)。
(2)973K时,若反应③在一个容积为2L的反应容器内2min时达到平衡,有3mol电子发生转移,则在2min内v(CO2)= 。若压缩容器的容积为原来的一半,平衡将 移动(选填“向左”,“向右”,“不”),CO2的浓度将 (选填“增大”,“减小”,“不变”)。使该反应的平衡转化率及平衡常数都增大的措施有 。
(3)在FeCl3稀溶液中滴加KSCN溶液后呈红色,反应的离子方程式是 ;若在其中加入少量KCl固体,溶液的颜色________(选填“变深”,“变浅”,“不变”)。
(4)若先往FeCl3溶液中加入足量NaF溶液,再滴加KSCN溶液,则不呈红色,若再加入足够量FeCl3溶液.又会呈现红色。请对上述实验现象作出解释 。
(1)吸热。K2/K1(2分)
(2)0.375 mol·(L·s)-1 。不,增大。升温。
(3)Fe3++3SCN-→Fe(SCN)3 ;(2分)不变。
(4)F-与Fe3+反应生成更为稳定的无色FeF63-。当再加入足量的FeCl3溶液时,溶液又呈血红色,说明SCN-没有被消耗。(2分)
【解析】
试题分析:(1)温度升高,该反应平衡常数变大,反应正向进行,正反应为吸热反应;方程式①-②=③,所以K3=K2/K1;
(2)CO(g)+ H2O(g) 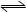 CO2(g)+ H2(g),反应中每1molCO参与反应,转移电子数为2mol,故有3mol电子发生转移有1.5mol
CO反应生成1.5mol CO2,v(CO2)=1.5÷2÷2=0.375
mol·(L·s)-1;若压缩容器的容积为原来的一半,即为增大反应气体的压强,该反应反应前后气体体积不变,平衡不移动;体积减小,反应物和生成物浓度均增大,根据表中数据计算两种温度下K3,确定该反应为吸热反应,升高温度,平衡正向进行且反应速率加快;
CO2(g)+ H2(g),反应中每1molCO参与反应,转移电子数为2mol,故有3mol电子发生转移有1.5mol
CO反应生成1.5mol CO2,v(CO2)=1.5÷2÷2=0.375
mol·(L·s)-1;若压缩容器的容积为原来的一半,即为增大反应气体的压强,该反应反应前后气体体积不变,平衡不移动;体积减小,反应物和生成物浓度均增大,根据表中数据计算两种温度下K3,确定该反应为吸热反应,升高温度,平衡正向进行且反应速率加快;
(4)若先往FeCl3溶液中加入足量NaF溶液,再滴加KSCN溶液,则不呈红色,说明溶液中没有Fe3+,即F-与Fe3+反应生成更为稳定的无色FeF63-,当再加入足量的FeCl3溶液时,溶液又呈血红色,说明SCN-没有被消耗。
考点:考查化学平衡、水解平衡等平衡原理有关问题。

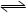 FeO(s)+CO(g)
FeO(s)+CO(g)