网址:http://m.1010jiajiao.com/timu3_id_40845[举报]
(1)乙烯的分子式是______.
(2)可以用来鉴别甲烷和乙烯的试剂是______.A.水 B. 稀硫酸 C.溴的四氯化碳溶液 D.酸性高锰酸钾溶液
(3)在一定条件下,乙烯能与水反应生成有机物A. A的结构简式是______.
(4)有机物A和乙酸都是生活中常见的有机物,A与乙酸反应的化学方程式是,反应类型为______.
(5)某同学在学习A的知识后,设计了如下实验.操作步骤为:
①在试管里加入2mL A;
②把一端弯成螺旋状的铜丝放在酒精灯外焰中加热;
③立即将铜丝插入盛有A的试管里,反复操作几次;
④闻生成物的气味,观察铜丝表面的变化.
试回答下列问题:
(1)该实验的目的是______;
(2)第④步操作中,铜丝表面的变化是______;
(3)写出反应的化学方程式______.
(1)乙烯的分子式是 .
(2)可以用来鉴别甲烷和乙烯的试剂是 .A.水 B. 稀硫酸 C.溴的四氯化碳溶液 D.酸性高锰酸钾溶液
(3)在一定条件下,乙烯能与水反应生成有机物A. A的结构简式是 .
(4)有机物A和乙酸都是生活中常见的有机物,A与乙酸反应的化学方程式是,反应类型为 .
(5)某同学在学习A的知识后,设计了如下实验.操作步骤为:
①在试管里加入2mL A;
②把一端弯成螺旋状的铜丝放在酒精灯外焰中加热;
③立即将铜丝插入盛有A的试管里,反复操作几次;
④闻生成物的气味,观察铜丝表面的变化.
试回答下列问题:
(1)该实验的目的是 ;
(2)第④步操作中,铜丝表面的变化是 ;
(3)写出反应的化学方程式 . 查看习题详情和答案>>
(1)乙烯的分子式是
(2)可以用来鉴别甲烷和乙烯的试剂是
(3)在一定条件下,乙烯能与水反应生成有机物A. A的结构简式是
(4)有机物A和乙酸都是生活中常见的有机物,A与乙酸反应的化学方程式是,反应类型为
(5)某同学在学习A的知识后,设计了如下实验.操作步骤为:
①在试管里加入2mL A;
②把一端弯成螺旋状的铜丝放在酒精灯外焰中加热;
③立即将铜丝插入盛有A的试管里,反复操作几次;
④闻生成物的气味,观察铜丝表面的变化.
试回答下列问题:
(1)该实验的目的是
(2)第④步操作中,铜丝表面的变化是
(3)写出反应的化学方程式
| 加热 |
| 加热 |
(一)FeSO4?7H2O的制备
该化学兴趣小组的同学在实验室通过如下实验由废铁屑(含少量氧化铜、氧化铁等杂质)制备FeSO4?7H2O晶体:
①将5% Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热数分钟,用倾析法除去Na2CO3溶液,然后将废铁屑用水洗涤2~3遍.
②向洗涤过的废铁屑中加入过量的稀硫酸,控制温度在50~80℃之间至铁屑耗尽;
③趁热过滤,将滤液转入到密闭容器中,静置、冷却结晶;
④待结晶完毕后,滤出晶体,用少量冰水洗涤2~3次,再用滤纸将晶体吸干;
⑤将制得的FeSO4?7H2O晶体放在一个小广口瓶中,密闭保存.
请回答下列问题:
(1)实验步骤①的目的是
(2)实验步骤②明显不合理,理由是
(3)为了洗涤除去晶体表面附着的硫酸等杂质,实验步骤④中用少量冰水洗涤晶体,原因是
(二)探究绿矾(FeSO4?7H2O)热分解的产物
已知SO3的熔点是16.8℃,沸点是44.8℃,该小组设计如图所示的实验装置(图中加热、夹持仪器等均省略):
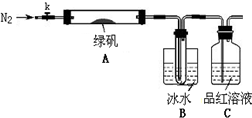
实验过程:
①仪器连接后,检查装置A与B气密性;
②取一定量绿矾固体置于A中,通入N2以驱尽装置内的空气,关闭k,用酒精灯加热硬质玻璃管;
③观察到A 中固体逐渐变红棕色,B中试管收集到无色液体,C中溶液褪色;
④待A中反应完全并冷却至室温后,取少量反应后固体于试管中,加入硫酸溶解,取少量滴入几滴KSCN溶液,溶液变红色;
⑤往B装置的试管中滴入几滴BaCl2溶液,溶液变浑浊.
(4)实验结果分析
结论1:B中收集到的液体是
结论2:C中溶液褪色,可推知产物中有
结论3:综合分析上述实验③和④可推知固体产物一定有Fe2O3.
实验反思:
(5)请指出该小组设计的实验装置的明显不足:
(6)分解后的固体中可能含有少量FeO,取上述实验④中盐酸溶解后的溶液少许于试管中,选用一种试剂鉴别,该试剂最合适的是
a.氯水和KSCN溶液 b.酸性KMnO4溶液 c.H2O2 d.NaOH溶液. 查看习题详情和答案>>
绿矾(FeSO4?7H2O)是治疗缺铁性贫血的特效药。某学校的化学兴趣小组的同学对绿矾进行了如下的探究:
FeSO4?7H2O的制备
该化学兴趣小组的同学在实验室通过如下实验由废铁屑(含少量氧化铜、氧化铁等杂质)制备FeSO4·7H2O晶体:
①将5%Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热数分钟,用倾析法除去
Na2CO3溶液,然后将废铁屑用水洗涤2~3遍。
②向洗涤过的废铁屑中加入过量的稀硫酸,控制温度在50~80℃之间至铁屑耗尽;
③趁热过滤,将滤液转入到密闭容器中,静置、冷却结晶;
④待结晶完毕后,滤出晶体,用少量冰水洗涤2~3次,再用滤纸将晶体吸干;
⑤将制得的FeSO4·7H2O晶体放在一个小广口瓶中,密闭保存。
请回答下列问题:
(1)实验步骤①的目的是 。
(2)实验步骤②明显不合理,理由是 。
(3)为了洗涤除去晶体表面附着的硫酸等杂质,实验步骤④中用少量冰水洗涤晶体,原因是 。
(二)探究绿矾(FeSO4·7H2O)热分解的产物
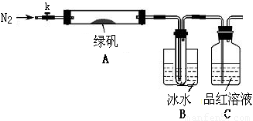 已知SO3的熔点是16.8°C,沸点是44.8°C,该小组设计如下图所示的实验装置(图中加热、夹持仪器等均省略):
已知SO3的熔点是16.8°C,沸点是44.8°C,该小组设计如下图所示的实验装置(图中加热、夹持仪器等均省略):
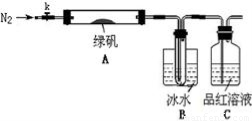
【实验过程】
①仪器连接后,检查装置A与B气密性;
②取一定量绿矾固体置于A中,通入N2以驱尽装置内的空气,关闭k,用酒精灯加热硬质玻璃管;
③观察到A 中固体逐渐变红棕色,B中试管收集到无色液体,C中溶液褪色;
④待A中反应完全并冷却至室温后,取少量反应后固体于试管中,加入硫酸溶解,取少量滴入几滴KSCN溶液,溶液变红色;
⑤往B装置的试管中滴入几滴BaCl2溶液,溶液变浑浊。
(4)实验结果分析
结论1:B中收集到的液体是?????????????????? ;
结论2:C中溶液褪色,可推知产物中有???? ?????????????? ;
结论3:综合分析上述实验③和④可推知固体产物一定有Fe2O3。
【实验反思】
(5)请指出该小组设计的实验装置的明显不足:??????????????????????????? 。
(6)分解后的固体中可能含有少量FeO,取上述实验④中盐酸溶解后的溶液少许于试管中,选用一种试剂鉴别,该试剂最合适的是?????????? 。
a.氯水和KSCN溶液???? b.酸性KMnO4溶液????? c.H2O2???? d.NaOH溶液
查看习题详情和答案>>