题目内容
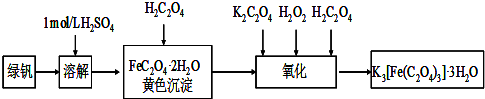
绿矾(FeSO4?7H2O)是治疗缺铁性贫血的特效药.某学校的化学兴趣小组的同学对绿矾进行了如下的探究:(一)FeSO4?7H2O的制备
该化学兴趣小组的同学在实验室通过如下实验由废铁屑(含少量氧化铜、氧化铁等杂质)制备FeSO4?7H2O晶体:
①将5% Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热数分钟,用倾析法除去Na2CO3溶液,然后将废铁屑用水洗涤2~3遍.
②向洗涤过的废铁屑中加入过量的稀硫酸,控制温度在50~80℃之间至铁屑耗尽;
③趁热过滤,将滤液转入到密闭容器中,静置、冷却结晶;
④待结晶完毕后,滤出晶体,用少量冰水洗涤2~3次,再用滤纸将晶体吸干;
⑤将制得的FeSO4?7H2O晶体放在一个小广口瓶中,密闭保存.
请回答下列问题:
(1)实验步骤①的目的是
(2)实验步骤②明显不合理,理由是
(3)为了洗涤除去晶体表面附着的硫酸等杂质,实验步骤④中用少量冰水洗涤晶体,原因是
(二)探究绿矾(FeSO4?7H2O)热分解的产物
已知SO3的熔点是16.8℃,沸点是44.8℃,该小组设计如图所示的实验装置(图中加热、夹持仪器等均省略):
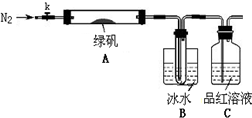
实验过程:
①仪器连接后,检查装置A与B气密性;
②取一定量绿矾固体置于A中,通入N2以驱尽装置内的空气,关闭k,用酒精灯加热硬质玻璃管;
③观察到A 中固体逐渐变红棕色,B中试管收集到无色液体,C中溶液褪色;
④待A中反应完全并冷却至室温后,取少量反应后固体于试管中,加入硫酸溶解,取少量滴入几滴KSCN溶液,溶液变红色;
⑤往B装置的试管中滴入几滴BaCl2溶液,溶液变浑浊.
(4)实验结果分析
结论1:B中收集到的液体是
结论2:C中溶液褪色,可推知产物中有
结论3:综合分析上述实验③和④可推知固体产物一定有Fe2O3.
实验反思:
(5)请指出该小组设计的实验装置的明显不足:
(6)分解后的固体中可能含有少量FeO,取上述实验④中盐酸溶解后的溶液少许于试管中,选用一种试剂鉴别,该试剂最合适的是
a.氯水和KSCN溶液 b.酸性KMnO4溶液 c.H2O2 d.NaOH溶液.
分析:(1)碳酸钠的水溶液显碱性,可以除去铁屑表面的油污;
(2)废铁屑中含少量氧化铜、氧化铁等杂质;
(3)降低溶解度,减少损失;
(4)硫酸钡是白色沉淀,二氧化硫能使品红褪色;
(5)二氧化硫会对大气造成污染;
(6)2价铁离子能使酸性KMnO4溶液褪色.
(2)废铁屑中含少量氧化铜、氧化铁等杂质;
(3)降低溶解度,减少损失;
(4)硫酸钡是白色沉淀,二氧化硫能使品红褪色;
(5)二氧化硫会对大气造成污染;
(6)2价铁离子能使酸性KMnO4溶液褪色.
解答:解:(1)碳酸钠的水溶液显碱性,可以除去铁屑表面的油污,故答案为:除油污;
(2)废铁屑中含少量氧化铜、氧化铁等杂质,与硫酸反应后,溶液中会混有铁离子和铜离子,故铁屑应过量,故答案为:应该铁屑过量,否则溶液中可能有铁离子和铜离子存在;
(3)绿矾易溶于水,降温可以降低其溶解度,减少损失,故答案为:用冰水洗涤可降低洗涤过程中FeSO4?7H2O的损耗;
(4)往B装置的试管中滴入几滴BaCl2溶液,溶液变浑浊,说明B中收集到的液体是硫酸溶液;品红溶液褪色,说明有SO2生成,故答案为:H2SO4溶液;SO2;
(5)二氧化硫会对大气造成污染;故应有尾气吸收装置,故答案为:在C装置后增加一套尾气处理装置;
(6)2价铁离子具有还原性,能使酸性KMnO4溶液褪色,故答案为:b.
(2)废铁屑中含少量氧化铜、氧化铁等杂质,与硫酸反应后,溶液中会混有铁离子和铜离子,故铁屑应过量,故答案为:应该铁屑过量,否则溶液中可能有铁离子和铜离子存在;
(3)绿矾易溶于水,降温可以降低其溶解度,减少损失,故答案为:用冰水洗涤可降低洗涤过程中FeSO4?7H2O的损耗;
(4)往B装置的试管中滴入几滴BaCl2溶液,溶液变浑浊,说明B中收集到的液体是硫酸溶液;品红溶液褪色,说明有SO2生成,故答案为:H2SO4溶液;SO2;
(5)二氧化硫会对大气造成污染;故应有尾气吸收装置,故答案为:在C装置后增加一套尾气处理装置;
(6)2价铁离子具有还原性,能使酸性KMnO4溶液褪色,故答案为:b.
点评:本题是一道实验探究题,能较好的考查学生分析和解决问题的能力,解答时要依据题干提供信息,结合相关知识细心分析解答.

练习册系列答案
相关题目