摘要:15.如右上图所示..是两个位于固定斜面上的长方体物块.它们的质量相等.F是沿水平方向作用于物体上的外力.已知与的接触面.及与斜面间的接触面都是光滑的.下列说法正确的是 ( ) A.a.b一定沿斜面向上运动 B.a对b的作用力沿水平方向 C.a.b对斜面的正压力相等 D.a受到的合力沿水平方向的分力等于b受到的合力沿水平方向的分力
网址:http://m.1010jiajiao.com/timu3_id_407162[举报]
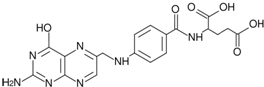
 研究CO、NO、NO2等气体的性质,以便消除污染或变废为宝,可以保护环境、节约资源.试运用所学知识,解决下列问题:
研究CO、NO、NO2等气体的性质,以便消除污染或变废为宝,可以保护环境、节约资源.试运用所学知识,解决下列问题:(1)生产水煤气过程中有以下反应:
①C(s)+CO2(g)?2CO(g)△H1;
②CO(g)+H2O(g)?H2(g)+CO2(g)△H2;
③C(s)+H2O(g)?CO(g)+H2(g)△H3;
若平衡表达式为K=
| c(H2)?c(CO) |
| c(H2O) |
△H2、△H3之间的关系为
(2)不同温度下反应②的平衡常数如下表所示.则△H2
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
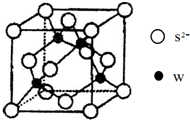 原子序数小于36的X、Y、Z、W四种元素,其中X原子基态时2p原子轨道上有3个未成对电子,Y原子基态时最外层电子数是其内层电子数的3倍,Z元素的最高价氧化物的水化物的酸性最强,W的原子序数为30.
原子序数小于36的X、Y、Z、W四种元素,其中X原子基态时2p原子轨道上有3个未成对电子,Y原子基态时最外层电子数是其内层电子数的3倍,Z元素的最高价氧化物的水化物的酸性最强,W的原子序数为30.(1)元素W的电子排布式为
(2)X、Y与氢元素形成的化合物XH2-YH中采用sp3杂化的原子有
(3)ZO4-离子的空间构型为
(4)元素W的一种硫化物晶体的晶胞结构如右上图所示,该硫化物的化学式是
 【化学一选修3物质结构与性质】
【化学一选修3物质结构与性质】已知A、B、C、D、E、F均为前四周期元素.A元素的原子价电子排布为ns2np2,B元素的最外层电子数是其电子层数的3倍,C元素原子的M电子层的P亚层中有3个未成对电子.D元素原子核外的M层中只有2对成对电子.B离子与E离子具有相同的电子层结构,可形成E2B2、E2B型化合物.F元素位于元素周期表的ds区,其原子与E原子具有相同的最外层电子数.
请回答下面的问题:
(1)根据以上信息推断:①B元素为
②F原子核外的价电子排布为
(2)指出在元素周期表中:①D元素在
(3)当n=2时,A与氢元素形成的相对分子质量为26的分子应属于
(4)当n=3时,A与B形成的晶体属于
(5)DCl2分子中,中心原子D有
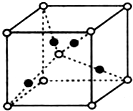
(6)元素F的某种氧化物的晶体晶胞结构如右上图所示,其中实心球表示F原子,则该氧化物的化学式为
(7)A-F六种元素中,有一种元素的部分电离能数据如下,它可能是
| 电离能 | I1 | I2 | I3 | I4 | I5 | I6 | I7 |
| (KJ.mol-1) | 14.5 | 29.6 | 47.4 | 77.5 | 97.9 | 551.9 | 666.8 |
 (2009?宿迁二模)聚合铁(简称PFS)化学式为:[Fe2(OH)n(SO4) 3-
(2009?宿迁二模)聚合铁(简称PFS)化学式为:[Fe2(OH)n(SO4) 3-| n | 2 |
(1)①PFS中铁显
+3
+3
价,铁原子的电子排布式是1s22s22p63s23p63d64s2
1s22s22p63s23p63d64s2
. ②O元素的第一电离能
小于
小于
N 元素的第一电离能(填“大于”或“小于”),原因因为O原子和N原子的外围电子排布分别为:2s22p4,2s22p3,N原子的p轨道半充满,相对稳定,所以第一电离能大,O失去一个电子后p轨道半充满,比较稳定,易失去1个电子,第一电力能小.
因为O原子和N原子的外围电子排布分别为:2s22p4,2s22p3,N原子的p轨道半充满,相对稳定,所以第一电离能大,O失去一个电子后p轨道半充满,比较稳定,易失去1个电子,第一电力能小.
;水分子中氧原子的杂化轨道类型为sp3
sp3
.H2O与H+以配位键结合成H3O+的立体结构为三角锥形
三角锥形
.(2)水在不同的温度和压力条件下可以形成11种不同结构的晶体,密度从比水轻的0.92g/cm3扩到约为水的一倍半.冰是人们迄今已知的由一种简单分子堆积出结构花样最多的化合物.其中冰一Ⅶ的晶体结构为一个如右上图所示的立方晶胞,每个水分子可与周围
4
4
个水分子以氢键结合,晶体中,1mol水可形成2
2
mol氢键.(3)已知下列元素的电负性数据:H:2.1,O:3.5,F:4.0.OF2与水的立体结构相似,但水分子的极性比OF2强得多,其原因有:①OF2中氧原子上有两对孤对电子,抵消了F一O键中共用电子对偏向F而产生的极性;②从电负性上看,
氧与氢的电负性差大于氧与氟的电负性差
氧与氢的电负性差大于氧与氟的电负性差
.