题目内容
 (2009?宿迁二模)聚合铁(简称PFS)化学式为:[Fe2(OH)n(SO4) 3-
(2009?宿迁二模)聚合铁(简称PFS)化学式为:[Fe2(OH)n(SO4) 3-| n | 2 |
(1)①PFS中铁显
+3
+3
价,铁原子的电子排布式是1s22s22p63s23p63d64s2
1s22s22p63s23p63d64s2
. ②O元素的第一电离能
小于
小于
N 元素的第一电离能(填“大于”或“小于”),原因因为O原子和N原子的外围电子排布分别为:2s22p4,2s22p3,N原子的p轨道半充满,相对稳定,所以第一电离能大,O失去一个电子后p轨道半充满,比较稳定,易失去1个电子,第一电力能小.
因为O原子和N原子的外围电子排布分别为:2s22p4,2s22p3,N原子的p轨道半充满,相对稳定,所以第一电离能大,O失去一个电子后p轨道半充满,比较稳定,易失去1个电子,第一电力能小.
;水分子中氧原子的杂化轨道类型为sp3
sp3
.H2O与H+以配位键结合成H3O+的立体结构为三角锥形
三角锥形
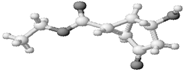
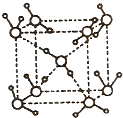
.(2)水在不同的温度和压力条件下可以形成11种不同结构的晶体,密度从比水轻的0.92g/cm3扩到约为水的一倍半.冰是人们迄今已知的由一种简单分子堆积出结构花样最多的化合物.其中冰一Ⅶ的晶体结构为一个如右上图所示的立方晶胞,每个水分子可与周围
4
4
个水分子以氢键结合,晶体中,1mol水可形成2
2
mol氢键.(3)已知下列元素的电负性数据:H:2.1,O:3.5,F:4.0.OF2与水的立体结构相似,但水分子的极性比OF2强得多,其原因有:①OF2中氧原子上有两对孤对电子,抵消了F一O键中共用电子对偏向F而产生的极性;②从电负性上看,
氧与氢的电负性差大于氧与氟的电负性差
氧与氢的电负性差大于氧与氟的电负性差
.分析:(1)铁元素的两种阳离子,亚铁离子在空气中不能稳定存在,而铁离子在空气中科院稳定存在,可以推断化合价为+3价,铁的核外电子排布式为1s22s22p63s23p63d64s2,有d电子;一般来说,最外层电子数越多,第一电离能越大,但氧和氮的第一电离能出现反常,是因为O原子和N原子的外围电子排布分别为:2s22p4,2s22p3,N 原子的 p 轨道半充满,相对稳定,而O失去一个电子后p轨道半充满,比较稳定,易失去1个电子,电离能小与N的;水分子中氧原子的杂化类型,水合氢离子的结构类型;
(2)看图一中间的水分子为对象数数与之相连的水分子个数和氢键数目;
(3)比较极性时,电负性相差大的极性大等知识点来解题.
(2)看图一中间的水分子为对象数数与之相连的水分子个数和氢键数目;
(3)比较极性时,电负性相差大的极性大等知识点来解题.
解答:解:(1)①絮状物在空气之中能稳定存在说明为铁离子,因为亚铁离子在空气中不稳定,故铁的化合价为+3价,铁的核外电子排布为1s22s22p63s23p63d64s2,
故答案为:+3;1s22s22p63s23p63d64s2;
②因为O原子和N原子的外围电子排布分别为:2s22p4,2s22p3,N 原子的p轨道半充满,相对稳定,所以第一电离能大,O失去一个电子后p轨道半充满,比较稳定,易失去1个电子,电离能较小;水分子中氧原子有1个s轨道,3个p轨道参与杂化,故杂化轨道类型sp3;H3O+中有三个O-H键连在氧上,同时氧上方还有一对孤对电子,故立体结构为三角锥形.
故答案为:小于;因为O原子和N原子的外围电子排布分别为:2s22p4,2s22p3,N原子的p轨道半充满,相对稳定,所以第一电离能大,O失去一个电子后p轨道半充满,比较稳定,易失去1个电子,第一电力能小;sp3;三角锥形;
(2)从图中可以看出,每个中心的水分子与上方面的2个对角的水分子形成氢键,与下方面的另外角的两个水分子形成氢键,共四个;以中间的水分子为例,1mol水形成了2mol氢键,故答案为:4;2;
(3)水分子的极性比OF2强得多,是因为氧与氟的电负性差比较小,而氧与氢的电负性差比较大,
故答案为:氧与氢的电负性差大于氧与氟的电负性差.
故答案为:+3;1s22s22p63s23p63d64s2;
②因为O原子和N原子的外围电子排布分别为:2s22p4,2s22p3,N 原子的p轨道半充满,相对稳定,所以第一电离能大,O失去一个电子后p轨道半充满,比较稳定,易失去1个电子,电离能较小;水分子中氧原子有1个s轨道,3个p轨道参与杂化,故杂化轨道类型sp3;H3O+中有三个O-H键连在氧上,同时氧上方还有一对孤对电子,故立体结构为三角锥形.
故答案为:小于;因为O原子和N原子的外围电子排布分别为:2s22p4,2s22p3,N原子的p轨道半充满,相对稳定,所以第一电离能大,O失去一个电子后p轨道半充满,比较稳定,易失去1个电子,第一电力能小;sp3;三角锥形;
(2)从图中可以看出,每个中心的水分子与上方面的2个对角的水分子形成氢键,与下方面的另外角的两个水分子形成氢键,共四个;以中间的水分子为例,1mol水形成了2mol氢键,故答案为:4;2;
(3)水分子的极性比OF2强得多,是因为氧与氟的电负性差比较小,而氧与氢的电负性差比较大,
故答案为:氧与氢的电负性差大于氧与氟的电负性差.
点评:本题考查了铁元素的核外电子排布和在空气中稳定存在化合价,第一电离能大小比较,看晶胞图判断分子个数和氢键个数,极性大小的判断方法等知识点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目