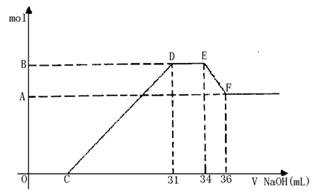
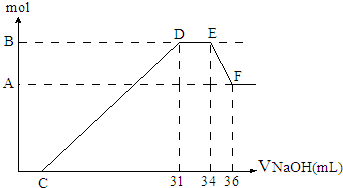
摘要:10. 硝酸发生氧化还原反应的时候.一般硝酸浓度越稀.对应的还原产物中氮的化合价越低.现有一定量的铝铁合金与一定量稀HNO3充分反应.反应过程中无任何气体放出.在反应结束后的溶液中.逐滴加入4mol /L NaOH溶液.所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示.下列说法中不正确的是 A.合金与硝酸反应时硝酸过量 B.合金中铝的物质的量为0.008mol C.合金中金属的物质的量共为0.032mol D.无法求出C点的值
网址:http://m.1010jiajiao.com/timu3_id_406578[举报]
硝酸发生氧化还原反应的时候,一般硝酸浓度越稀,对应还原产物中氮的化合价越低.现有一定量的铝粉和铁粉的混合物与一定量很稀HNO3充分反应,反应过程中无任何气体放出.在反应结束后的溶液中,逐渐加入4mol/LNaOH溶液,所加NaOH溶液的体积(ml)与产生沉淀的物质的量(mol)关系如图所示.求:
(1)反应中硝酸的还原产物为
(2)B与A的差值:
(3)C的数值:

查看习题详情和答案>>
(1)反应中硝酸的还原产物为
硝酸铵
硝酸铵
(填名称).DE段是否发生了化学反应是
是
(填“是”或“否”).(2)B与A的差值:
0.008
0.008
mol; B的数值:0.032
0.032
mol.(写出计算过程)(3)C的数值:
7
7
ml.
 硝酸发生氧化还原反应的时候,一般硝酸浓度越稀,对应还原产物中氮的化合物越低.现有一定量的铝粉和铁粉的混合物与一定量很稀的HNO3充分反应,反应过程中无任何气体放出.在反应结束后的溶液中,逐滴加入4mol?L-1NaOH溶液.所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示:
硝酸发生氧化还原反应的时候,一般硝酸浓度越稀,对应还原产物中氮的化合物越低.现有一定量的铝粉和铁粉的混合物与一定量很稀的HNO3充分反应,反应过程中无任何气体放出.在反应结束后的溶液中,逐滴加入4mol?L-1NaOH溶液.所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示:(1)和铝粉和铁粉的混合物反应时,HNO3对应还原产物为
NH4NO3
NH4NO3
(填化学式);(2)完成下列过程中的离子反应方程式:
O→C
H++OH-═H2O
H++OH-═H2O
;D→ENH4++OH-═NH3?H2O
NH4++OH-═NH3?H2O
;E→FAl(OH)3+OH-=AlO2-+2H2O
Al(OH)3+OH-=AlO2-+2H2O
;(3)B值是多少mol?写出计算过程.
(10分)硝酸发生氧化还原反应的时候,一般硝酸浓度越稀,对应还原产物中氮的化合价越低。若硝酸现有一定量的铝粉和铁粉的混合物与一定量很稀的HNO3充分反应,反应过程中无任何气体放出。在反应结束后的溶液中,逐滴加入4mol /LNaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示。求:
(1)B与A的差值: mol;
(2)B的数值: mol;
(3)C的数值: mL。(要求有计算过程)