网址:http://m.1010jiajiao.com/timu3_id_406459[举报]
| a | |||||||||||||||||
| b | c | d | |||||||||||||||
| e | f | g | h | i | |||||||||||||
(1)元素a在元素周期表中的位置是
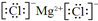
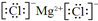
(2)元素c和g中,非金属性较强的是
(3)写出由cd2转化为cd的化学方程式:
| ||
| ||
 (1)图表法、图象法是常用的科学研究方法.短周期某主族元素M的电离能情况如图(A)所示.则M元素位于周期表的第
(1)图表法、图象法是常用的科学研究方法.短周期某主族元素M的电离能情况如图(A)所示.则M元素位于周期表的第(2).人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属被科学家预测为是钛(22Ti),它被誉为“未来世纪的金属”.
试回答下列问题:
I.Ti元素的基态原子的价电子层排布式为
II.在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定;
①偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构示意图如图C,它的化学式是
②已知Ti3+可形成配位数为6的配合物.现有含钛的两种颜色的晶体,一种为紫色,另一种为绿色,但相关实验证明,两种晶体的组成皆为TiCl3?6H2O.为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种配合物晶体的样品配成待测溶液;
b.分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤得两份沉淀,洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的
| 2 | 3 |
海水中含有丰富的镁资源。工业上常用海水晒盐后的苦卤水提取Mg,流程如下图所示:

(1)工业制取镁的方法是 法。
(2)试剂Ⅰ一般选用 (填化学式)。
(3)下图是金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态)。

①由图可知Mg与卤素单质的反应均为 (填“放热”或“吸热”)反应;推测化合物的热稳定性顺序为MgI2 MgF2(填“>”、“=”或“<”)。
②依上图数据写出MgBr2(s)与Cl2(g)反应的热化学方程式 。
(4)金属Mg与CH3Cl在一定条件下反应可生成CH3MgCl,CH3MgCl是一种重要的有机合成试剂,易与水发生水解反应并有无色无味气体生成。写出CH3MgCl水解的化学方程式 。
(5)向Mg(OH)2中加入NH4Cl溶液,可使沉淀溶解,请结合平衡原理和必要的文字解释原因 。
查看习题详情和答案>>
(选做题)(19分)图表法、模型法是常用的科学研究方法。
I.下图是研究部分元素的氢化物的沸点变化规律的图像。不同同学对某主族元素氢化物的沸点的变化趋势画出了两条折线——折线a和折线b(其中A点对应的沸点是100℃),你认为正确的是 ,理由是 。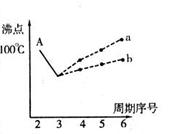
II.人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属则被科学家预测为是钛(Ti)。钛被誉为“未来世纪的金属”。试回答下列问题:
(1)22Ti元素基态原子的价电子层排布式为 。
(2)在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定。偏钛酸钡的热稳定性好,价电常数高,在小型变压器、话筒和扩音器中都有应用。偏钛酸钡晶体中晶胞的结构示意图如右图,则它的化学式是 。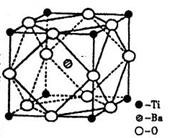
III.上世纪60年化,第一个稀有气体化合物Xe[PtF6]被合成出来后,打破了“绝对情性”的观念。在随后的几年内,科学家又相继后成了氙的氟化物、氧化物等。
(1)金属Pt内部原子的堆积方式与铜及干冰中的CO2相同,右图正方体是Pt晶胞的示意图,试说出Pt原子在晶胞中的位置 。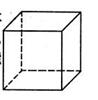
(2)稀有气体(氡除外)中,只有较重的氙能合成出多种化合物,
其可能原因是 (填字母代号)
| A.氙的含量比较丰富 | B.氙的相对原子质量大 |
| C.氙原子半径大,电离能小 | D.氙原子半径小,电负性大 |