摘要:在80℃时.将0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中.发生如下反应:N2O4 2NO2.隔一段时间对该容器内的物质进行分析.得到如下数据: (1)计算20s-40s内用N2O4表示的平均反应速率为 mol/L. (1)计算20s-40s内用N2O4表示的平均反应速率为 mol/L.S, (2)计算在80℃时该反应的平衡常数K= , (3)反应进行至100s后将反应混合物的温度降低.混合气体的颜色(填“变浅 .“变深 或“不变 ) , (4)要增大该反应的K值.可采取的措施有 A.增大N2O4的起始浓度 B.向混合气体中通入NO2 C.使用高效催化剂 D.升高温度 (5)如图是80℃时容器中N2O4物质的量的变化 曲线.请在该图中补画出该反应在60℃时 N2O4物质的量的变化曲线.
网址:http://m.1010jiajiao.com/timu3_id_404875[举报]
在80℃时,将0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4?2NO2,隔一段时间对该容器内的物质进行分析,得到如下数据:
(1)计算20~40s内用N2O4表示的平均反应速率为 mol?L-1?s-1.
(2)计算在80℃时该反应的平衡常数K= .
(3)反应进行至100s后将反应混合物的温度降低,混合气体的颜色 (填“变浅”、“变深”或“不变”).
(4)要增大该反应的K值,可采取的措施有 (填字母).
a.增大N2O4起始浓度
b.向混合气体中通入NO2
c.使用高效催化剂
d.升高温度.
查看习题详情和答案>>
| 时间/s n/mol |
0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(2)计算在80℃时该反应的平衡常数K=
(3)反应进行至100s后将反应混合物的温度降低,混合气体的颜色
(4)要增大该反应的K值,可采取的措施有
a.增大N2O4起始浓度
b.向混合气体中通入NO2
c.使用高效催化剂
d.升高温度.
80℃时,将0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4(g)?2NO2(g)△H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
①计算20s-40s内用N2O4表示的平均反应速率为
②计算在80℃时该反应的平衡常数K=
③反应进行至100s后将反应混合物的温度降低,混合气体的颜色(填“变浅”、“变深”或“不变”)
④要增大该反应的K值,可采取的措施有(填序号)
A.增大N2O4的起始浓度 B.向混合气体中通入NO2
C.使用高效催化剂 D.升高温度
⑤在同条件下,如果将0.40mol的N2O4气体充入2L已经抽空的固定容积的绝热密闭容器中,最终达到平衡后n(NO2)
查看习题详情和答案>>
| 时间(s) n(mol) |
0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
0.002mol/(L?S)
0.002mol/(L?S)
;②计算在80℃时该反应的平衡常数K=
1.8mol?L-1
1.8mol?L-1
;③反应进行至100s后将反应混合物的温度降低,混合气体的颜色(填“变浅”、“变深”或“不变”)
变浅
变浅
;④要增大该反应的K值,可采取的措施有(填序号)
D
D
.A.增大N2O4的起始浓度 B.向混合气体中通入NO2
C.使用高效催化剂 D.升高温度
⑤在同条件下,如果将0.40mol的N2O4气体充入2L已经抽空的固定容积的绝热密闭容器中,最终达到平衡后n(NO2)
<
<
0.60mol(填“>”、“<”或“=”).(8分)80℃时,将0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4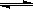 2NO2 △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2 △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间(s) n(mol) | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
②计算在80℃时该反应的平衡常数K= ;
③反应进行至l00s后将反应混合物的温度降低,混合气体的颜色(填“变浅”、“变深”或“不变”) ;
④要增大该反应的K值,可采取的措施有(填序号) ;
A.增大N2O4的起始浓度 B.向混合气体中通入NO2 C.使用高效催化剂 D.升高温度 查看习题详情和答案>>
(8分)80℃时,将0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4
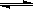 2NO2
△H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2
△H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
|
时间(s) n(mol) |
0 |
20 |
40 |
60 |
80 |
100 |
|
n(N2O4) |
0.40 |
a |
0.20 |
c |
d |
e |
|
n(NO2) |
0.00 |
0.24 |
b |
0.52 |
0.60 |
0.60 |
①计算20s—40s内用N2O4表示的平均反应速率为
②计算在80℃时该反应的平衡常数K= ;
③反应进行至l00s后将反应混合物的温度降低,混合气体的颜色(填“变浅”、“变深”或“不变”) ;
④要增大该反应的K值,可采取的措施有(填序号) ;
A.增大N2O4的起始浓度 B.向混合气体中通入NO2 C.使用高效催化剂 D.升高温度
查看习题详情和答案>>
 在80℃时,将0.40mol的N204气体充入2L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4?2NO2,隔一段时间对该容器内的物质进行分析,得到如下数据:
在80℃时,将0.40mol的N204气体充入2L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4?2NO2,隔一段时间对该容器内的物质进行分析,得到如下数据:| 时间(s) n(mol) |
0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
0.0020
0.0020
mol?L-1?S-1;(2)计算在80℃时该反应的平衡常数K=
1.8mol?L-1
1.8mol?L-1
(请注明单位).(3)反应进行至100s后将反应混合物的温度降低,混合气体的颜色(填“变浅”.“变深”或“不变”)
变浅
变浅
;(4)要增大该反应的K值,可采取的措施有(填序号)
D
D
:A.增大N2O4的起始浓度 B.向混合气体中通入NO2 C.使用高效催化剂 D.升高温度
(5)如图是80℃时容器中N204物质的量的变化曲线,请在该图中补画出该反应在60℃时N204物质的量的变化曲线.