摘要:23.原子序数递增的部分短周期主族元素的原子半径数据如下表: 元素 A B D E F G M N P 原子半径/nm 0.077 0.075 0.074 0.071 0.186 0.160 0.143 0.102 0.099 (1)已知A.B.D.E.N.P为非金属元素.在周期表中的位置如下.请将相应元素符号填在表中. (2)B在周期表中的位置为 . AD2的电子式为 . (3)N的最高价氧化物的水化物与A单质反应的 化学方程式为 . (4)M的最高价氧化物的水化物是药物“胃舒平 的主要成分.可以治疗胃酸过多.反应的离子 方程式为 .F的最高价氧化物的水化物也可以中和胃酸.不用其治疗胃酸过多的原因是 . (5)AD2与ND2性质相似.G在ND2中也可以剧烈燃烧.反应的化学方程式为 . 24.下图中.P为一可自由滑动的活塞.关闭K.分别向容器A.B中均各充入2molX.2molY.起始时.VA=aL.VB=0.8aL.在相同温度和催化剂存在的条件下.两容器中各自发生下述反应:3X+2W(g).达到平衡时.VB=0.6aL. 试回答下列问题: (1)B中X的转化率为 . (2)A.B中的X的转化率的关系是A B(填“> .“= .“< ).理由是 . (3)平衡时A.B中混合气体的平均相对分子质量的关系是:MA MB(填“> .“= .“< ) (4)如果要计算出平衡时B中混合气体的密度.则至少还需要知道的数据是 (MX.MY.MZ.MW分别表示X.Y.Z.W的摩尔质量). ①MX ②MY ③MZ ④MW A.③和④ B.①和② C.①和③ D.②③④ (5)打开K.一段时间后反应再次达到平衡.则B的体积为 L
网址:http://m.1010jiajiao.com/timu3_id_402993[举报]
原子序数递增的部分短周期主族元素的原子半径数据如下表:
(1)已知A、B、D、E、N、P为非金属元素,且均不与F、G、M中的任何一种元素同族,在周期表中的相对位置如下,请将相应元素符号填在表中.
(2)B在周期表中的位置为______;AD2的电子式为______.
(3)M的最高价氧化物的水化物是胃药“胃舒平”的主要成分,可以治疗胃酸过多,反应的离子方程式为______.
(4)AD2与ND2性质相似,G在ND2中也可以剧烈燃烧,可能的产物是______,反应的化学方程式为______.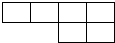
查看习题详情和答案>>
| 元素 | A | B | D | E | F | G | M | N | P |
| 原子半径/nm | 0.077 | 0.070 | 0.066 | 0.064 | 0.186 | 0.160 | 0.143 | 0.104 | 0.099 |
(2)B在周期表中的位置为______;AD2的电子式为______.
(3)M的最高价氧化物的水化物是胃药“胃舒平”的主要成分,可以治疗胃酸过多,反应的离子方程式为______.
(4)AD2与ND2性质相似,G在ND2中也可以剧烈燃烧,可能的产物是______,反应的化学方程式为______.

原子序数递增的部分短周期主族元素的原子半径数据如下表:
(1)已知A、B、D、E、N、P为非金属元素,且均不与F、G、M中的任何一种元素同族,在周期表中的相对位置如下,请将相应元素符号填在表中.
(2)B在周期表中的位置为______;AD2的电子式为______.
(3)M的最高价氧化物的水化物是胃药“胃舒平”的主要成分,可以治疗胃酸过多,反应的离子方程式为______.
(4)AD2与ND2性质相似,G在ND2中也可以剧烈燃烧,可能的产物是______,反应的化学方程式为______ 2MgO+S,Mg+S MgS
MgS
 查看习题详情和答案>>
查看习题详情和答案>>
| 元素 | A | B | D | E | F | G | M | N | P |
| 原子半径/nm | 0.077 | 0.070 | 0.066 | 0.064 | 0.186 | 0.160 | 0.143 | 0.104 | 0.099 |
(2)B在周期表中的位置为______;AD2的电子式为______.
(3)M的最高价氧化物的水化物是胃药“胃舒平”的主要成分,可以治疗胃酸过多,反应的离子方程式为______.
(4)AD2与ND2性质相似,G在ND2中也可以剧烈燃烧,可能的产物是______,反应的化学方程式为______ 2MgO+S,Mg+S
 MgS
MgS 查看习题详情和答案>>
查看习题详情和答案>>
有四种短周期元素的部分性质如下,请根据有关信息填空:
注:气体密度已换算为标准状况
(1)元素W在周期表中的位置
(2)短周期主族元素中,元素X以及与其相邻元素的气态氢化物的稳定性由强到弱顺序是:
(3)同族元素单质及其化合物在许多性质上都存在着递变规律.下列有关说法正确的是
a.元素W所在族,随着原子序数递增,单质的熔点逐渐降低
b.元素X所在族,随着原子序数递增,对应简单离子的还原性逐渐增强
c.元素Y所在族,随着原子序数递增,对应氢化物的沸点逐渐升高
d.元素Z所在族,随着原子序数递增,最高氧化物对应水化物的酸性逐渐增强
(4)Z单质与足量Y单质反应,生成物的电子式为
 ,已知生成1mol该产物将伴随393.51kJ的热量变化,写出该反应的热化学方程式
,已知生成1mol该产物将伴随393.51kJ的热量变化,写出该反应的热化学方程式
查看习题详情和答案>>
| 元素 | W | X | Y | Z |
| 原子半径 | 186pm | 99pm | 66pm | 77pm |
| 核外电子 | 有4种能级不同的电子 | 最外层有7种运动状态不同的电子 | 核外电子占有5个轨道 | 有2个未成对电子 |
| 单质 部分 性质 |
密度:0.97g?cm-3 熔点:97.8℃ 能导电 |
沸点:-34.0℃ 不能导电 |
密度:1.43g?L-1 沸点:-183.0℃ 不能导电 |
熔点:3550℃ 能导电 |
(1)元素W在周期表中的位置
第三周期第ⅠA族
第三周期第ⅠA族
,根据性质描述,元素Z的单质是石墨
石墨
(写名称),上述元素的简单离子中半径最小的是Na+
Na+
(写离子符号).(2)短周期主族元素中,元素X以及与其相邻元素的气态氢化物的稳定性由强到弱顺序是:
HF>HCl>H2S
HF>HCl>H2S
(用化学式表示).(3)同族元素单质及其化合物在许多性质上都存在着递变规律.下列有关说法正确的是
b
b
(选填序号).a.元素W所在族,随着原子序数递增,单质的熔点逐渐降低
b.元素X所在族,随着原子序数递增,对应简单离子的还原性逐渐增强
c.元素Y所在族,随着原子序数递增,对应氢化物的沸点逐渐升高
d.元素Z所在族,随着原子序数递增,最高氧化物对应水化物的酸性逐渐增强
(4)Z单质与足量Y单质反应,生成物的电子式为


C(s)+O2(g)=CO2△H=-393.51kJ/mol
C(s)+O2(g)=CO2△H=-393.51kJ/mol
.
有四种短周期元素的部分性质如下,请根据有关信息填空:
注:气体密度已换算为标准状况
(1)元素W在周期表中的位置______,根据性质描述,元素Z的单质是______(写名称),上述元素的简单离子中半径最小的是______(写离子符号).
(2)短周期主族元素中,元素X以及与其相邻元素的气态氢化物的稳定性由强到弱顺序是:______(用化学式表示).
(3)同族元素单质及其化合物在许多性质上都存在着递变规律.下列有关说法正确的是______(选填序号).
a.元素W所在族,随着原子序数递增,单质的熔点逐渐降低
b.元素X所在族,随着原子序数递增,对应简单离子的还原性逐渐增强
c.元素Y所在族,随着原子序数递增,对应氢化物的沸点逐渐升高
d.元素Z所在族,随着原子序数递增,最高氧化物对应水化物的酸性逐渐增强
(4)Z单质与足量Y单质反应,生成物的电子式为______,已知生成1mol该产物将伴随393.51kJ的热量变化,写出该反应的热化学方程式______.
查看习题详情和答案>>
| 元素 | W | X | Y | Z |
| 原子半径 | 186pm | 99pm | 66pm | 77pm |
| 核外电子 | 有4种能级不同的电子 | 最外层有7种运动状态不同的电子 | 核外电子占有5个轨道 | 有2个未成对电子 |
| 单质 部分 性质 | 密度:0.97g?cm-3 熔点:97.8℃ 能导电 | 沸点:-34.0℃ 不能导电 | 密度:1.43g?L-1 沸点:-183.0℃ 不能导电 | 熔点:3550℃ 能导电 |
(1)元素W在周期表中的位置______,根据性质描述,元素Z的单质是______(写名称),上述元素的简单离子中半径最小的是______(写离子符号).
(2)短周期主族元素中,元素X以及与其相邻元素的气态氢化物的稳定性由强到弱顺序是:______(用化学式表示).
(3)同族元素单质及其化合物在许多性质上都存在着递变规律.下列有关说法正确的是______(选填序号).
a.元素W所在族,随着原子序数递增,单质的熔点逐渐降低
b.元素X所在族,随着原子序数递增,对应简单离子的还原性逐渐增强
c.元素Y所在族,随着原子序数递增,对应氢化物的沸点逐渐升高
d.元素Z所在族,随着原子序数递增,最高氧化物对应水化物的酸性逐渐增强
(4)Z单质与足量Y单质反应,生成物的电子式为______,已知生成1mol该产物将伴随393.51kJ的热量变化,写出该反应的热化学方程式______.
查看习题详情和答案>>
 (2011?福建模拟)原子序数递增的部分短周期主族元素的原子半径数据如下表:
(2011?福建模拟)原子序数递增的部分短周期主族元素的原子半径数据如下表:| 元素 | A | B | D | E | F | G | M | N | P |
| 原子半径/nm | 0.077 | 0.070 | 0.066 | 0.064 | 0.186 | 0.160 | 0.143 | 0.104 | 0.099 |
(2)B在周期表中的位置为
第二周期VA族
第二周期VA族
;AD2的电子式为

(3)M的最高价氧化物的水化物是胃药“胃舒平”的主要成分,可以治疗胃酸过多,反应的离子方程式为
Al(OH)3+3H+═Al3++3H2O
Al(OH)3+3H+═Al3++3H2O
.(4)AD2与ND2性质相似,G在ND2中也可以剧烈燃烧,可能的产物是
MgO、MgS、S
MgO、MgS、S
,反应的化学方程式为2Mg+SO2
2MgO+S,Mg+S
MgS
| ||
| ||
2Mg+SO2
2MgO+S,Mg+S
MgS
.
| ||
| ||