摘要:21.A.B.C.D.E为前20号元素.原子序数依次增大.其中A.D同主族.B.C.D同周期.B.C.D最高价氧化物对应的水化物均能相互反应生成盐和水.A.B.E的单质均能和水剧烈反应.E+与D的阴离子具有相同的电子层结构. ⑴A.B.C.D四种元素的原子半径由小到大的顺序是 .⑵A和D的氢化物中 的沸点较高.原因是 . ⑶写出E单质与水反应的离子方程式 . ⑷B和D形成的晶体中.每个阳离子与它最近且等距的阳离子共有 个.
网址:http://m.1010jiajiao.com/timu3_id_401305[举报]
A、B、C、D、E为前20号元素,原子序数依次增大,其中A、D同主族,B、C、D同周期,B、C、D最高价氧化物对应的水化物均能相互反应生成盐和水.A、B、E的单质均能和水剧烈反应,E+与D的阴离子具有相同的电子层结构.
(1)A、B、C、D四种元素的原子半径由小到大的顺序是 (用元素符号表示).
(2)A和D的氢化物中 (用化学式表示)的沸点较高,原因是 .
(3)写出E单质与水反应的离子方程式 .
(4)B和D形成的晶体中,每个阳离子与它最近且等距的阳离子共有 个.
查看习题详情和答案>>
(1)A、B、C、D四种元素的原子半径由小到大的顺序是
(2)A和D的氢化物中
(3)写出E单质与水反应的离子方程式
(4)B和D形成的晶体中,每个阳离子与它最近且等距的阳离子共有
(8分)A、B、C、D、E为前20号元素,原子序数依次增大,其中A、D同主族,B、C、D同周期,B、C、D最高价氧化物对应的水化物均能相互反应生成盐和水。A、B、E的单质均能和水剧烈反应,E+与D的阴离子具有相同的电子层结构。
(1)A、B、C、D四种元素的原子半径由小到大的顺序是 (用元素符号表示)。
(2)A和D的氢化物中 (用化学式表示)的沸点较高,原因是 。
(3)写出E单质与水反应的离子方程式 。
(4)B和D形成的晶体中,每个阳离子的周围与它最近且等距的阳离子共有 个。
查看习题详情和答案>> A、B、C、D、E都是元素周期表中前20号的元素,原子序数依次增大,B、C、D同周期,A、D同主族,E和其它元素既不在同周期也不在同主族,B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水.A和E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如图所示,阳离子(用“●”表示)位于该正方体的顶点或面心;阴离子(用“○”表示)位于小正方体的中心.
A、B、C、D、E都是元素周期表中前20号的元素,原子序数依次增大,B、C、D同周期,A、D同主族,E和其它元素既不在同周期也不在同主族,B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水.A和E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如图所示,阳离子(用“●”表示)位于该正方体的顶点或面心;阴离子(用“○”表示)位于小正方体的中心.根据以上信息,回答下列问题:
(1)比较A和D的氢化物,后者的沸点较低,
(2)其原因是
HF中分子间存在氢键,使沸点反常高
HF中分子间存在氢键,使沸点反常高
(2)B的离子结构示意图为


第三周期ⅢA族
第三周期ⅢA族
;(3)A和E形成的化合物的电子式是


(4)C原子的电子排布式是
1s22s22p63s23p1
1s22s22p63s23p1
.A、B、C、D、E、F为六种20号以前的元素,其核电荷数依次增大,A、B同周期,两者相隔一元素;B、D同主族相邻,A、B、D三种元素的核电荷数之为和30.C、E能形成CE型化合物.F的次外层有8个电子,已知它的最外不止一个电子.回答:
(1)A、B、C、D、E、F为六种元素的符号分别为
(2)用化学式表示A、D、E最高价氧化物的水化物酸性由强到弱的顺序:
(3)用化学式表示比较A、B气态氢化物的稳定性:
(4)用化学式表示比较D、E氢化物的还原性:
查看习题详情和答案>>
(1)A、B、C、D、E、F为六种元素的符号分别为
C
C
、O
O
、Na
Na
、S
S
、Cl
Cl
、K
K
;(2)用化学式表示A、D、E最高价氧化物的水化物酸性由强到弱的顺序:
HClO4>H2SO4>H2CO3
HClO4>H2SO4>H2CO3
;(3)用化学式表示比较A、B气态氢化物的稳定性:
CH4<H2O
CH4<H2O
;(4)用化学式表示比较D、E氢化物的还原性:
H2S>HCl
H2S>HCl
.A、B、C、D、E都是元素周期表中前20号元素,原子序数依次增大,B、C、D同周期,A、D原子中某p能级均排有5个电子,E和其它元素既不在同周期也不在同主族,B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水.
根据以上信息,回答下列问题:
(1)A和D的氢化物中,沸点较低的是 (填“A”或“D”);
A和D的电负性较大的是 (填“A”或“D”);
B和C的第一电离能较小的是 (填“B”或“C”);
A和B的离子中,半径较小的是 (填离子符号);
元素C的原子核外电子排布式为 ;
C单质的晶体中原子以 键相结合.
(2)写出B、C的最高价氧化物的水化物相互反应的离子方程式: 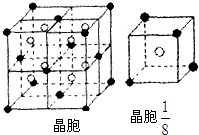
(3)A和E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如图所示,阳离子(用“●”表示)于该正方体的顶点或面心;阴离子(用“〇”表示)均位于小正方体中心.该化合物的化学式是
(4)已知晶胞
的体积为2.0×10-23cm3,求A和E组成的离子化合物的密度,请列式并计算,结果保留一位小数. .
查看习题详情和答案>>
根据以上信息,回答下列问题:
(1)A和D的氢化物中,沸点较低的是
A和D的电负性较大的是
B和C的第一电离能较小的是
A和B的离子中,半径较小的是
元素C的原子核外电子排布式为
C单质的晶体中原子以
(2)写出B、C的最高价氧化物的水化物相互反应的离子方程式:

(3)A和E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如图所示,阳离子(用“●”表示)于该正方体的顶点或面心;阴离子(用“〇”表示)均位于小正方体中心.该化合物的化学式是
(4)已知晶胞
| 1 | 8 |