摘要:.利用阿伏加德罗常数.估算在标准状态下相邻气体分子间的平均距离D.
网址:http://m.1010jiajiao.com/timu3_id_401107[举报]
 (2013?临沂三模)[化学--物质结构与性质]
(2013?临沂三模)[化学--物质结构与性质]开发新型储氢材料是氢能利用的重要研究方向.
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得.
①Ti的基态原子有
7
7
种能量不同的电子.②LiBH4由Li+和BH4-构成,BH4-的空间构型是
正四面体
正四面体
,LiBH4中不存在的作用力有c
c
(填代号).a.离子键 b.共价键 c.金属键 d.配位键
③Li、B、H元素的电负性由大到小排列顺序为
H>B>Li
H>B>Li
.(2)MgH2是金属氢化物储氢材料,其晶胞结构如右图所示. 已知该晶体的密度ag?cm-3,则该晶胞的体积为
| 52 |
| a.NA |
| 52 |
| a.NA |
(3)一种具有储氢功能的铜合金晶体具有立方最密堆积的结构,晶胞中Cu原子处于面心,Au原子处于顶点位置,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中.若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构为CaF2的结构相似,该晶体储氢后的化学式为
Cu3AuH8
Cu3AuH8
.(2013?南开区一模)2013年初天津连续出现了严重的雾霾天气,给人们的出行及身体造成了极大的危害.研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
(1)利用钠碱循环法可脱除烟气中的SO2.
①在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是
②吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
由上表判断,NaHSO3溶液显
③当吸收液的pH降至约为6时,需送至电解槽再生.再生示意图如下:

写出HSO3-在阳极放电的电极反应式:
(2)用CH4催化还原NOx可以消除氮氧化物的污染.例如:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g);△H=-574kJ?mol-1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g);△H=-1160kJ?mol-1
若用标准状况下4.48L CH4还原NO2至N2,整个过程中转移的电子总数为
(3)工业上合成氮所需氢气的制备过程中,其中的一步反应为:CO(g)+H2O(g)
CO2(g)+H2(g);△H<0
一定条件下,将CO(g)与H2O(g)以体积比为l:2置于密闭容器中发生上述反应,达到平衡时测得CO(g)与H2O(g)体积比为l:6,则平衡常数K=
.
查看习题详情和答案>>
(1)利用钠碱循环法可脱除烟气中的SO2.
①在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是
2OH-+SO2=SO32-+H2O
2OH-+SO2=SO32-+H2O
.②吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
| n(SO32-):n(HSO3-) | 91:9 | 1:l | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
酸
酸
性(填“酸”、“碱”或“中”),用化学平衡原理解释:HSO3-存在HSO3-?H++SO32- 和HSO3-+H2O?H2SO3+OH-,HSO3-的电离程度大于水解程度
HSO3-存在HSO3-?H++SO32- 和HSO3-+H2O?H2SO3+OH-,HSO3-的电离程度大于水解程度
.③当吸收液的pH降至约为6时,需送至电解槽再生.再生示意图如下:

写出HSO3-在阳极放电的电极反应式:
HSO3-+H2O-2e-=SO42-+3H+
HSO3-+H2O-2e-=SO42-+3H+
,当阴极室中溶液pH升至8以上时,吸收液再生并循环利用.(2)用CH4催化还原NOx可以消除氮氧化物的污染.例如:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g);△H=-574kJ?mol-1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g);△H=-1160kJ?mol-1
若用标准状况下4.48L CH4还原NO2至N2,整个过程中转移的电子总数为
1.60NA(或1.6NA)
1.60NA(或1.6NA)
(阿伏加德罗常数的值用NA表示),放出的热量为173.4
173.4
kJ.(3)工业上合成氮所需氢气的制备过程中,其中的一步反应为:CO(g)+H2O(g)
| 催化剂 |
一定条件下,将CO(g)与H2O(g)以体积比为l:2置于密闭容器中发生上述反应,达到平衡时测得CO(g)与H2O(g)体积比为l:6,则平衡常数K=
| 8 |
| 3 |
| 8 |
| 3 |
[化学一选修3:物质结构与性质]
一水硫酸四氨合铜(Ⅱ)(化学式为[Cu(NH3)4SO4?H2O]是一种重要的染料及农药中间体.某学习小组以孔雀石(主要成分为Cu2(OH)2CO3,含少量Fe2O3和SO2杂质)为原料制备该物质的流程如下图:

请回答:
(1)沉淀A的晶体中最小环上的原子个数为 ,气体C分子中σ键和π键的个数比为 .
2)溶液D的溶质阴离子的空间构型为 ,其中心原子的杂化轨道类型为 .
3)MgO的熔点高于CuO的原因为 .
4)画出一水硫酸四氨合铜(Ⅱ)中配离子([Cu(NH3)4]2+)的配位键 .
(5)湿法炼铜就是利用溶液D制得铜单质,铜单质晶体中原子的堆积方式如图甲所示,其晶胞如图乙所示,原子之间相互位置关系的平面图如图丙所示.
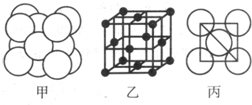
①铜单质晶体中原子的堆积方式为 ,晶胞中Cu原子的配位数为 .
若Cu原子半径为acm,则Cu单质晶体的密度为 g/cm3(只列出计算式,阿伏加德罗常数的值为NA).
查看习题详情和答案>>
一水硫酸四氨合铜(Ⅱ)(化学式为[Cu(NH3)4SO4?H2O]是一种重要的染料及农药中间体.某学习小组以孔雀石(主要成分为Cu2(OH)2CO3,含少量Fe2O3和SO2杂质)为原料制备该物质的流程如下图:

请回答:
(1)沉淀A的晶体中最小环上的原子个数为
2)溶液D的溶质阴离子的空间构型为
3)MgO的熔点高于CuO的原因为
4)画出一水硫酸四氨合铜(Ⅱ)中配离子([Cu(NH3)4]2+)的配位键
(5)湿法炼铜就是利用溶液D制得铜单质,铜单质晶体中原子的堆积方式如图甲所示,其晶胞如图乙所示,原子之间相互位置关系的平面图如图丙所示.

①铜单质晶体中原子的堆积方式为
若Cu原子半径为acm,则Cu单质晶体的密度为