题目内容
 (2013?临沂三模)[化学--物质结构与性质]
(2013?临沂三模)[化学--物质结构与性质]开发新型储氢材料是氢能利用的重要研究方向.
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得.
①Ti的基态原子有
7
7
种能量不同的电子.②LiBH4由Li+和BH4-构成,BH4-的空间构型是
正四面体
正四面体
,LiBH4中不存在的作用力有c
c
(填代号).a.离子键 b.共价键 c.金属键 d.配位键
③Li、B、H元素的电负性由大到小排列顺序为
H>B>Li
H>B>Li
.(2)MgH2是金属氢化物储氢材料,其晶胞结构如右图所示. 已知该晶体的密度ag?cm-3,则该晶胞的体积为
| 52 |
| a.NA |
| 52 |
| a.NA |
(3)一种具有储氢功能的铜合金晶体具有立方最密堆积的结构,晶胞中Cu原子处于面心,Au原子处于顶点位置,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中.若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构为CaF2的结构相似,该晶体储氢后的化学式为
Cu3AuH8
Cu3AuH8
.分析:(1)①该原子中电子填充几种能级就有几种不同能量的电子;
②根据价层电子对互斥理论确定离子空间构型,阴阳离子之间存在离子键,非金属元素之间存在共价键,含有孤电子对的原子和含有空轨道的原子之间存在配位键;
③元素的非金属性越强,其电负性越大;
(2)先根据均摊法确定该晶胞中含有的各种原子个数,从而得出其质量,再根据V=
计算其体积;
(3)CaF2的结构如图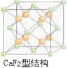 ,利用均摊法计算.
,利用均摊法计算.
②根据价层电子对互斥理论确定离子空间构型,阴阳离子之间存在离子键,非金属元素之间存在共价键,含有孤电子对的原子和含有空轨道的原子之间存在配位键;
③元素的非金属性越强,其电负性越大;
(2)先根据均摊法确定该晶胞中含有的各种原子个数,从而得出其质量,再根据V=
| m |
| ρ |
(3)CaF2的结构如图
 ,利用均摊法计算.
,利用均摊法计算.解答:解:(1)①Ti的基态原子核外电子排布式为:1s22s22p63s22p63d24s2,电子填充了7种能级,所以有7种不同能量的电子,故答案为:7;
②BH4-中B原子价层电子数=4+
(3+1-4×1)=4,且不含孤电子对,所以是正四面体构型,Li+和BH-4之间存在离子键,硼原子和氢原子之间存在共价键、配位键,所以该化合物中不含金属键,故选c,
故答案为:正四面体,c;
③非金属的非金属性越强其电负性越大,非金属性最强的是H元素,其次是B元素,最小的是Li元素,所以Li、B、H元素的电负性由大到小排列顺序为H>B>Li,
故答案为:H>B>Li;
(2)该晶胞中镁原子个数=
×8+1=2,氢原子个数=4×
+2=4,V=
=
cm3=
cm3,
故答案为:
;
(3)CaF2的结构如图 ,根据题意知,该晶胞中铜原子个数=6×
,根据题意知,该晶胞中铜原子个数=6×
=3,金原子个数=8×
=1
,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中,则H原子应位于晶胞内部,氢原子相当于该晶胞中的F离子,所以该晶胞中应含有8个H,所以其化学式为Cu3AuH8,
故答案为:Cu3AuH8.
②BH4-中B原子价层电子数=4+
| 1 |
| 2 |
故答案为:正四面体,c;
③非金属的非金属性越强其电负性越大,非金属性最强的是H元素,其次是B元素,最小的是Li元素,所以Li、B、H元素的电负性由大到小排列顺序为H>B>Li,
故答案为:H>B>Li;
(2)该晶胞中镁原子个数=
| 1 |
| 8 |
| 1 |
| 2 |
| m |
| ρ |
| ||
| ρ |
| 52 |
| a.NA |
故答案为:
| 52 |
| a.NA |
(3)CaF2的结构如图
 ,根据题意知,该晶胞中铜原子个数=6×
,根据题意知,该晶胞中铜原子个数=6×| 1 |
| 2 |
| 1 |
| 8 |
,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中,则H原子应位于晶胞内部,氢原子相当于该晶胞中的F离子,所以该晶胞中应含有8个H,所以其化学式为Cu3AuH8,
故答案为:Cu3AuH8.
点评:本题考查物质结构和性质,涉及核外电子排布、杂化方式的判断、空间构型的判断、晶胞的计算等知识点,难点是晶胞的计算,灵活运用公式是解本题关键,难度中等.

练习册系列答案
相关题目

 -CH3
-CH3 -CH2Br
-CH2Br
