摘要:共价键:A. 相关概念:B. 共价化合物:只有非金属的化合物 C. 共价化合物形成过程的电子式的表示(NH3.CH4.CO2.HClO.H2O2)D 极性键与非极性键
网址:http://m.1010jiajiao.com/timu3_id_40087[举报]
化学与生活密切相关,下列有关说法正确的有( )个
①糖类、蛋白质、油脂属于天然高分子化合物
②煤经气化和液化两个物理变化过程,可变为清洁能源
③制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料
④用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口放出
⑤苯、油脂均不能使酸性KMnO4溶液褪色
⑥葡萄糖、果糖的分子式均为C6H12O6,二者互为同分异构体
⑦甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应
⑧乙醇、乙酸均能与Na反应放出H2,二者分子中官能团相同
⑨中和滴定实验时,用待测液润洗锥形瓶=10
⑩.非金属元素组成的化合物中只含共价键.
①糖类、蛋白质、油脂属于天然高分子化合物
②煤经气化和液化两个物理变化过程,可变为清洁能源
③制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料
④用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口放出
⑤苯、油脂均不能使酸性KMnO4溶液褪色
⑥葡萄糖、果糖的分子式均为C6H12O6,二者互为同分异构体
⑦甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应
⑧乙醇、乙酸均能与Na反应放出H2,二者分子中官能团相同
⑨中和滴定实验时,用待测液润洗锥形瓶=10
⑩.非金属元素组成的化合物中只含共价键.
| A、1 | B、2 | C、3 | D、4 |
(2008?天津)某天然有机化合物A仅含C、H、O元素,与A相关的反应框图如下:

(1)写出下列反应的反应类型:
S→A第①步反应
D→E第①步反应
(2)B所含官能团的名称是
(3)写出A、P、E、S的结构式:
A:
 、P:
、P:
 、E:
、E:
 .
.
(4)写出在浓H2SO4存在并加热的条件下,F与足量乙醇反应的化学方程式:
 .
.
(5)写出与D具有相同官能团的D的所有同分异构体的结构式: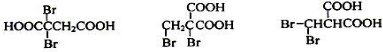
 .
.
查看习题详情和答案>>

(1)写出下列反应的反应类型:
S→A第①步反应
取代(或水解)反应
取代(或水解)反应
、B→D加成反应
加成反应
、D→E第①步反应
消去反应
消去反应
、A→P酯化(或取代)反应
酯化(或取代)反应
.(2)B所含官能团的名称是
碳碳双键、羧基
碳碳双键、羧基
.(3)写出A、P、E、S的结构式:
A:




HOOCC≡CCOOH
HOOCC≡CCOOH
、S:

(4)写出在浓H2SO4存在并加热的条件下,F与足量乙醇反应的化学方程式:


(5)写出与D具有相同官能团的D的所有同分异构体的结构式:


有机化合物A为一元溴代有机酸,仅含C、H、O、Br元素,与A相关的反应框图如图所示:

(1)写出下列反应的有机反应类型:A→C中是 反应,C→E是 反应.
(2)写出F的结构简式: .
(3)写出与C具有相同官能团的同分异构体的结构简式 .
(4)写出下列反应的化学方程式A→B: .
查看习题详情和答案>>

(1)写出下列反应的有机反应类型:A→C中是
(2)写出F的结构简式:
(3)写出与C具有相同官能团的同分异构体的结构简式
(4)写出下列反应的化学方程式A→B:
下列关于化学键的说法正确的是( )
①含有金属元素的化合物一定是离子化合物
②第IA族和第VIIA族原子化合时,一定生成离子键
③由非金属元素形成的化合物一定不是离子化合物
④活泼金属与非金属化合时,能形成离子键
⑤离子键就是阴、阳离子间的静电引力
⑥含有离子键的化合物一定是离子化合物
⑦离子化合物中可能同时含有离子键和共价键.
①含有金属元素的化合物一定是离子化合物
②第IA族和第VIIA族原子化合时,一定生成离子键
③由非金属元素形成的化合物一定不是离子化合物
④活泼金属与非金属化合时,能形成离子键
⑤离子键就是阴、阳离子间的静电引力
⑥含有离子键的化合物一定是离子化合物
⑦离子化合物中可能同时含有离子键和共价键.
查看习题详情和答案>>
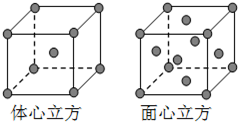 Fe为过渡元素,它的原子序数为26.回答下列问题:
Fe为过渡元素,它的原子序数为26.回答下列问题:(1)铁元素基态原子的电子排布式为
1s22s22p63s23p63d64s2
1s22s22p63s23p63d64s2
;(2)Fe原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物.
①与Fe原子或离子形成配合物的分子或离子应具备的结构特征是
具有孤对电子
具有孤对电子
;②Fe(CN)64-中的配体是CN-,中心离子是
Fe2+
Fe2+
.(3)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华.易溶于水,也易溶于乙醚、丙酮等有机溶剂.据此判断三氯化铁晶体为
分子晶体
分子晶体
晶体,并推知铁与氯之间的作用力为共价键
共价键
.A.共价键 B.离子键 C.分之间作用力 D.氢键
(4)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示.面心立方晶胞和体心立方晶胞中实际含有的Fe原子个数之比为
2:1
2:1
.