网址:http://m.1010jiajiao.com/timu3_id_3998189[举报]
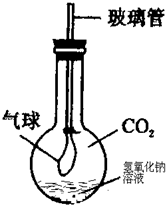 学习氢氧化钠的性质时,老师为了让同学们看到CO2与氢氧化钠反应有明显现象,设计了演示实验:给集满CO2的烧瓶中加入浓的氢氧化钠溶液,然后迅速盖上并塞紧带有玻璃管的胶塞,玻璃管下端套有一气球(如图).振荡烧瓶后,可看到的现象是
学习氢氧化钠的性质时,老师为了让同学们看到CO2与氢氧化钠反应有明显现象,设计了演示实验:给集满CO2的烧瓶中加入浓的氢氧化钠溶液,然后迅速盖上并塞紧带有玻璃管的胶塞,玻璃管下端套有一气球(如图).振荡烧瓶后,可看到的现象是原因是
写出该反应的化学方程式:
可是细心的小明同学发现,经老师用力振荡后烧瓶内液体呈白色浑浊!好学的小明同学很想知道白色浑浊是什么物质,为此他进行了以下的探究活动:
【查阅资料】(1)在氢氧化钠溶液中通入过量的二氧化碳会生成碳酸氢钠,该反应的化学方程式为
NaOH+CO2+H2O═NaHCO3;
(2)常温下,NaHCO3在水中的溶解度比Na2CO3小.Na2CO3过饱和后也会结晶析出.
(3)Ca(HCO3)2 可溶于水.
【猜想】猜想一:该白色浑浊物中只有Na2CO3;
猜想二:该白色浑浊物中只有NaHCO3;
猜想三:该白色浑浊物中可能有
【实验探究】
设计实验验证猜想:小明同学根据老师的提示将该浑浊液体加水搅拌后发现白色浑浊消失形成无色溶液!这些神奇的变化让小明更加好奇,他于是又设计了以下实验来验证其猜想:
| 实验步骤 | 实验现象 | 结论 |
| ①取少量加水后形成的无色溶液,加入过量CaCl2溶液,静置. | 出现白色沉淀(或无明显现象) 出现白色沉淀(或无明显现象) |
该溶液中 Na2CO3(或没有Na2CO3) Na2CO3(或没有Na2CO3) |
| ②再取步骤①的上层清液,加入 稀盐酸 稀盐酸 . |
有气泡冒出(或无明显现象) 有气泡冒出(或无明显现象) |
证明该溶液中 NaHCO3(或没有NaHCO3) NaHCO3(或没有NaHCO3) |
金属过氧化物等可作宇宙飞船或潜水艇中的氧气再生剂,如:过氧化钠(Na2O2)在常温下能与人呼出的二氧化碳反应生成氧气,化学方程式为:2Na2O2+2CO2===2Na2CO3+O2。为了验证该反应中氧气的产生,某兴趣小组的同学设计了如图所示的实验。

(1)A装置中所发生反应的化学方程式为 ;
实验室确定气体发生装置时应考虑的因素是 ;
检查A装置的气密性的方法是:将A装置中导气管上的胶皮管用弹簧夹夹住,往长颈漏斗中注入水至液面高出漏斗颈的下端管口,若能观察到
现象,即可证明装置不漏气。
(2)表明二氧化碳没有被过氧化钠完全吸收的现象是 。
(3)用向上排空气法收集氧气,并用带火星的木条放在集气瓶口检验氧气是否收集满,
这是利用了氧气的哪些性质?
(4)如果用脱脂棉包裹一定量的Na2O2固体,然后向其中通入CO2,脱脂棉很快就燃烧
此现象说明该反应过程中能量是如何变化的?
(5)常温下水也能与Na2O2反应,生成氧气和氢氧化钠,写出该反应的化学方程式。
若要检验干燥的二氧化碳能否与过氧化钠反应生成氧气,以上实验装置应如何改进?
(6)实验室中的过氧化钠如果保存不当,容易与空气中的CO2和水蒸汽发生反应变质。今称取10g过氧化钠样品(杂质不参加反应)放人烧杯中,向其中加入10g水,二者完全反应后。称量烧杯中剩余物质的总质量为18.4g(不包括烧杯的质量,且气体的溶解忽略不计)。试计算过氧化钠样品中杂质的质量分数。
查看习题详情和答案>>
金属过氧化物等可作宇宙飞船或潜水艇中的氧气再生剂,如:过氧化钠(Na2O2)在常温下能与人呼出的二氧化碳反应生成氧气,化学方程式为:2Na2O2+2CO2===2Na2CO3+O2。为了验证该反应中氧气的产生,某兴趣小组的同学设计了如图所示的实验。
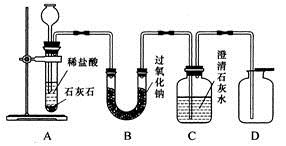
(1)A装置中所发生反应的化学方程式为 ;
实验室确定气体发生装置时应考虑的因素是 ;
检查A装置的气密性的方法是:将A装置中导气管上的胶皮管用弹簧夹夹住,往长颈漏斗中注入水至液面高出漏斗颈的下端管口,若能观察到
现象,即可证明装置不漏气。
(2)表明二氧化碳没有被过氧化钠完全吸收的现象是 。
(3)用向上排空气法收集氧气,并用带火星的木条放在集气瓶口检验氧气是否收集满,
这是利用了氧气的哪些性质?
(4)如果用脱脂棉包裹一定量的Na2O2固体,然后向其中通入CO2,脱脂棉很快就燃烧
此现象说明该反应过程中能量是如何变化的?
(5)常温下水也能与Na2O2反应,生成氧气和氢氧化钠,写出该反应的化学方程式。
若要检验干燥的二氧化碳能否与过氧化钠反应生成氧气,以上实验装置应如何改进?
(6)实验室中的过氧化钠如果保存不当,容易与空气中的CO2和水蒸汽发生反应变质。今称取10g过氧化钠样品(杂质不参加反应)放人烧杯中,向其中加入10g水,二者完全反应后。称量烧杯中剩余物质的总质量为18.4g(不包括烧杯的质量,且气体的溶解忽略不计)。试计算过氧化钠样品中杂质的质量分数。
金属过氧化物等可作宇宙飞船或潜水艇中的氧气再生剂,如:过氧化钠(Na2O2)在常温下能与人呼出的二氧化碳反应生成氧气,化学方程式为:2Na2O2+2CO2===2Na2CO3+O2。为了验证该反应中氧气的产生,某兴趣小组的同学设计了如图所示的实验。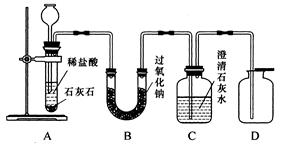
(1)A装置中所发生反应的化学方程式为 ;
实验室确定气体发生装置时应考虑的因素是 ;
检查A装置的气密性的方法是:将A装置中导气管上的胶皮管用弹簧夹夹住,往长颈漏斗中注入水至液面高出漏斗颈的下端管口,若能观察到
现象,即可证明装置不漏气。
(2)表明二氧化碳没有被过氧化钠完全吸收的现象是 。
(3)用向上排空气法收集氧气,并用带火星的木条放在集气瓶口检验氧气是否收集满,
这是利用了氧气的哪些性质?
(4)如果用脱脂棉包裹一定量的Na2O2固体,然后向其中通入CO2,脱脂棉很快就燃烧
此现象说明该反应过程中能量是如何变化的?
(5)常温下水也能与Na2O2反应,生成氧气和氢氧化钠,写出该反应的化学方程式。
若要检验干燥的二氧化碳能否与过氧化钠反应生成氧气,以上实验装置应如何改进?
(6)实验室中的过氧化钠如果保存不当,容易与空气中的CO2和水蒸汽发生反应变质。今称取10g过氧化钠样品(杂质不参加反应)放人烧杯中,向其中加入10g水,二者完全反应后。称量烧杯中剩余物质的总质量为18.4g(不包括烧杯的质量,且气体的溶解忽略不计)。试计算过氧化钠样品中杂质的质量分数。
金属过氧化物等可作宇宙飞船或潜水艇中的氧气再生剂,如:过氧化钠(Na2O2)在常温下能与人呼出的二氧化碳反应生成氧气,化学方程式为:2Na2O2+2CO2===2Na2CO3+O2。为了验证该反应中氧气的产生,某兴趣小组的同学设计了如图所示的实验。
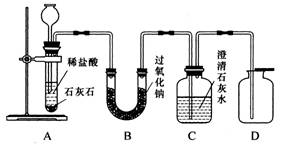
(1)A装置中所发生反应的化学方程式为 ;
实验室确定气体发生装置时应考虑的因素是 ;
检查A装置的气密性的方法是:将A装置中导气管上的胶皮管用弹簧夹夹住,往长颈漏斗中注入水至液面高出漏斗颈的下端管口,若能观察到
现象,即可证明装置不漏气。
(2)表明二氧化碳没有被过氧化钠完全吸收的现象是 。
(3)用向上排空气法收集氧气,并用带火星的木条放在集气瓶口检验氧气是否收集满,
这是利用了氧气的哪些性质?
(4)如果用脱脂棉包裹一定量的Na2O2固体,然后向其中通入CO2,脱脂棉很快就燃烧
此现象说明该反应过程中能量是如何变化的?
(5)常温下水也能与Na2O2反应,生成氧气和氢氧化钠,写出该反应的化学方程式。
若要检验干燥的二氧化碳能否与过氧化钠反应生成氧气,以上实验装置应如何改进?
(6)实验室中的过氧化钠如果保存不当,容易与空气中的CO2和水蒸汽发生反应变质。今称取10g过氧化钠样品(杂质不参加反应)放人烧杯中,向其中加入10g水,二者完全反应后。称量烧杯中剩余物质的总质量为18.4g(不包括烧杯的质量,且气体的溶解忽略不计)。试计算过氧化钠样品中杂质的质量分数。
查看习题详情和答案>>