题目内容
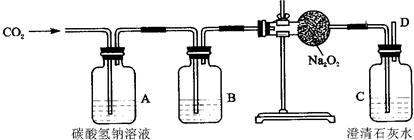
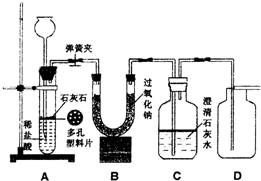
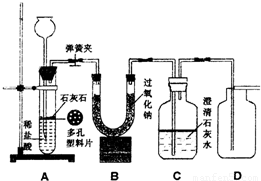
金属过氧化物等可作宇宙飞船或潜水艇中的氧气再生剂,如:过氧化钠(Na2O2)在常温下能与人呼出的二氧化碳反应生成氧气,化学方程式为:2Na2O2+2CO2===2Na2CO3+O2。为了验证该反应中氧气的产生,某兴趣小组的同学设计了如图所示的实验。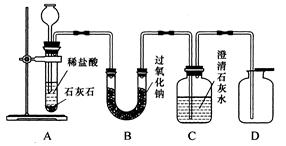
(1)A装置中所发生反应的化学方程式为 ;
实验室确定气体发生装置时应考虑的因素是 ;
检查A装置的气密性的方法是:将A装置中导气管上的胶皮管用弹簧夹夹住,往长颈漏斗中注入水至液面高出漏斗颈的下端管口,若能观察到
现象,即可证明装置不漏气。
(2)表明二氧化碳没有被过氧化钠完全吸收的现象是 。
(3)用向上排空气法收集氧气,并用带火星的木条放在集气瓶口检验氧气是否收集满,
这是利用了氧气的哪些性质?
(4)如果用脱脂棉包裹一定量的Na2O2固体,然后向其中通入CO2,脱脂棉很快就燃烧
此现象说明该反应过程中能量是如何变化的?
(5)常温下水也能与Na2O2反应,生成氧气和氢氧化钠,写出该反应的化学方程式。
若要检验干燥的二氧化碳能否与过氧化钠反应生成氧气,以上实验装置应如何改进?
(6)实验室中的过氧化钠如果保存不当,容易与空气中的CO2和水蒸汽发生反应变质。今称取10g过氧化钠样品(杂质不参加反应)放人烧杯中,向其中加入10g水,二者完全反应后。称量烧杯中剩余物质的总质量为18.4g(不包括烧杯的质量,且气体的溶解忽略不计)。试计算过氧化钠样品中杂质的质量分数。
(1)CaCO3+2HCl===CaCl2+H2O+CO2↑;反应物的状态和反应条件等
漏斗颈中形成一段稳定的水柱(或液面不再下降)等
(2)C装置处的澄清石灰水变浑浊
(3)氧气的密度比空气大,氧气能支持燃烧(或有助燃性)
(4)此反应是放热的
(5)2Na2O2+2H2O===4NaOH+O2↑;在A、B装置之间和B、C装置之间增加气体干燥装置(或盛有浓硫酸的洗气瓶)等。(说明:只要答出在A、B装置之间增加气体
干燥装置就给分)
(6)解:生成O2的质量为: 10g+10g-18.4g =1.6g …………(1分)
设过氧化钠样品中Na2O2的质量为X
2Na2O2 + 2H2O ="==" 4NaOH + O2↑
2×78 32
X 1.6g
2×78 /32 ="X/" 1.6g ……………………(1分)
X =7.8g ……………………(1分)
过氧化钠样品中杂质的质量分数为:10g-7.8g/10g×100% =22% ………………(1分)
答:过氧化钠样品中杂质的质量分数为22% 。
解析

 考前必练系列答案
考前必练系列答案