摘要:向滴有石蕊试液的稀盐酸中.慢慢滴入过量氢氧化钠溶液.石蕊颜色变化的过程是( ) A.红→蓝→紫 B.紫→蓝→红 C.蓝→紫→红 D.红→紫→蓝
网址:http://m.1010jiajiao.com/timu3_id_3988819[举报]
 某化学兴趣小组对“NaOH溶液与稀盐酸是否恰好完全反应”进行探究.
某化学兴趣小组对“NaOH溶液与稀盐酸是否恰好完全反应”进行探究.请你参与他们的探究活动,并回答有关问题.
[实验探究]
(1)方案一:某同学按右图所示的方法先向试管中加入约2mL NaOH溶液,再滴入几滴酚酞试液,溶液变红.然后慢慢滴入稀盐酸,边滴边振荡,直至溶液恰好变为
无
无
色,证明NaOH溶液与稀盐酸恰好完全反应.①请指出右图操作中的错误
胶头滴管伸入试管内
胶头滴管伸入试管内
.②写出NaOH溶液与稀盐酸反应的化学方程式
HCl+NaOH═NaCl+H2O
HCl+NaOH═NaCl+H2O
;(2)方案二:
| 实验步骤 | 实验现象 | 结论 |
| 取2mL NaOH溶液于试管中,滴入一定量的稀盐酸,振荡后加入锌粒 | 若 锌粒表面产生气泡 锌粒表面产生气泡 |
盐酸过量 |
| 若没有明显现象 | NaOH溶液与稀盐酸恰好完全反应 |
(3)方案一在滴入稀盐酸的过程中,若观察到曾有少量气泡出现,请分析产生气泡的原因可能是
部分NaOH吸收空气中的CO2变质为Na2CO3
部分NaOH吸收空气中的CO2变质为Na2CO3
(写出一条即可);(4)有同学提出方案二不能证明NaOH溶液与稀盐酸恰好完全反应,其原因是
盐酸不足时,锌不与NaOH反应,也没有明显现象
盐酸不足时,锌不与NaOH反应,也没有明显现象
.为此,还需要选择石蕊
石蕊
(填一种试剂),再进行实验即可.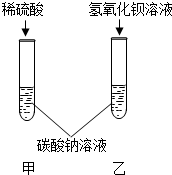 甲乙两同学为了验证碳酸钠的化学性质,做了如图所示的实验.乙同学的实验中发生反应的化学方程式为
甲乙两同学为了验证碳酸钠的化学性质,做了如图所示的实验.乙同学的实验中发生反应的化学方程式为Na2CO3+Ba(OH)2═BaCO3↓+2NaOH
Na2CO3+Ba(OH)2═BaCO3↓+2NaOH
.试验后,乙同学将除去沉淀后的废液倒入烧杯中,然后甲同学也将废液缓慢倒入同一烧杯中,发现烧杯中开始时没有现象,随后产生气泡.
根据上述现象推断,甲,乙两同学试管中的废液所含溶质分别是:甲
Na2SO4、H2SO4
Na2SO4、H2SO4
乙NaOH、Na2CO3
NaOH、Na2CO3
(均写化学式)【提出问题】:最终烧杯中的废液含有的溶质是多少
【猜想与假设】
猜想①:废液中含有Na2SO4 H2SO4两种物质.
猜想②:废液中只含有Na2SO4一种物质.
【活动与探究】
甲、乙同学为了验证猜想,分别取少量烧杯中的废液于试管中,进行了如下实验.
| 实验方案 | 现象 | 结论 | |
| 甲同学 | 向试管中滴加石蕊溶液 | 溶液变红 溶液变红 |
猜想①正确 |
| 乙同学 | 向试管中滴加稀盐酸 | 无明显现象 | 猜想①正确 |
硫酸钠不能和稀盐酸反应,若溶液中只有硫酸钠,溶液中也没有明显的现象
硫酸钠不能和稀盐酸反应,若溶液中只有硫酸钠,溶液中也没有明显的现象
. (2009?邵阳)2009年邵阳市九年级化学实验操作技能考试中,小聪同学抽到的试题是“探究酸和碱之间的中和反应“.他向盛有氢氧化钠溶液的烧杯中缓慢滴加稀盐酸,一会儿后,想起忘记加指示剂了,便补加几滴无色酚酞溶液,搅拌,观察到溶液不变色,于是他得出“酸碱恰好完全中和”的结论.
(2009?邵阳)2009年邵阳市九年级化学实验操作技能考试中,小聪同学抽到的试题是“探究酸和碱之间的中和反应“.他向盛有氢氧化钠溶液的烧杯中缓慢滴加稀盐酸,一会儿后,想起忘记加指示剂了,便补加几滴无色酚酞溶液,搅拌,观察到溶液不变色,于是他得出“酸碱恰好完全中和”的结论.(1)该中和反应的化学方程式是
NaOH+HCl=NaCl+H2O
NaOH+HCl=NaCl+H2O
;(2)老师给予小聪的评定是结论不准确.请你帮小聪分析老师的理由是:
可能盐酸过量,无色酚酞溶液遇酸性溶液也不变色
可能盐酸过量,无色酚酞溶液遇酸性溶液也不变色
(3)请你另外设计一个实验,探究小聪实验后烧杯中的溶液是否“恰好完全中和”.
填写下表:
| 实验步骤 | 实验现象 | 实验结论 |
取少量溶液于试管中,滴入几滴 紫色石蕊溶液 取少量溶液于试管中,滴入几滴 紫色石蕊溶液 |
溶液变红色 溶液变红色 |
稀盐酸过量 稀盐酸过量 |
溶液仍为紫色 (或不变色) 溶液仍为紫色 (或不变色) |
恰好完全中和 恰好完全中和 |