摘要:+n(Cu2O)=0.300mol <0.4mol 设其中一份中n(Cu)= x mol.n(Cu2O)= y mol.n(CuO)= z mol. 依得失电子守恒和氧元素守恒.有: 亦即反应后生成的硝酸铜的物质的量为0.350mol 则500mL稀硝酸中.n(HNO3)=0.350mol×2+0.100mol=0.800mol) 于是:c(HNO3)=0.800mol/0.500L=1.6mol/L
网址:http://m.1010jiajiao.com/timu3_id_398593[举报]
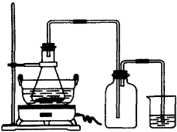 绿矾(FeSO4?7H2O)是重要的化学化工试剂,工业上常利用机械加工行业产生的废铁屑为原料制备.
绿矾(FeSO4?7H2O)是重要的化学化工试剂,工业上常利用机械加工行业产生的废铁屑为原料制备.请回答下列问题:
(1)图是某研究性学习小组用于制备绿矾的装置,其中集气瓶的作用是
(2)如图锥形瓶中的反应物是铁屑和28%的硫酸,反应前常用98%的硫酸配制500g 28%的硫酸,要算出所需98%的硫酸的体积,还要知道的数据是
(3)在制备硫酸亚铁的过程中,理论上控制铁过量或酸过量均有利于防止Fe2+被氧化.设计两个实验:实验一,控制酸过量;实验二,控制铁过量;其余步骤同,制得硫酸亚铁,并对产品质量进行检测.检测结果如下:
| 序号 | 反应物用量 | 产品质量 |
| 1 | n(H2SO4):n(Fe)>1:1 | 介于Ⅰ级~Ⅱ级之间 |
| 2 | n(H2SO4):n(Fe)<1:1 | 优于Ⅰ级 |
(4)该小组在继续研究由绿矾制备Fe(OH)2的过程中,发现出现白色的沉淀会逐渐转变为灰绿色,最后变为红褐色.甲同学查资料该灰绿色沉淀可能是Fe3(OH)8,请用氧化物的形式写出该沉淀
(2012?泰州二模)碱式碳酸铜的成分有多种,其化学式一般可表示为xCu(OH)2?yCuCO3.
(1)孔雀石呈绿色,是一种名贵的宝石,其主要成分是Cu(OH)2?CuCO3.某兴趣小组为探究制取孔雀石的最佳反应条件,设计了如下实验:
实验1:将2.0mL 0.50mol?L-1的Cu(NO3)2溶液、2.0mL 0.50mol?L-1的NaOH溶液和0.25mol?L-1的Na2CO3溶液按表Ⅰ所示体积混合.
实验2:将合适比例的混合物在表Ⅱ所示温度下反应.
实验记录如下:
表Ⅰ表Ⅱ
①实验室制取少许孔雀石,应该采用的条件是
②80℃时,所制得的孔雀石有少量褐色物质的原因是
(2)实验小组为测定上述某条件下所制得的碱式碳酸铜样品组成,利用下图所示的装置(夹持仪器省略)进行实验:

步骤1:检查装置的气密性,将过滤、洗涤并干燥过的样品置于平直玻璃管中.
步骤2:打开活塞K,鼓入空气,一段时间后关闭,称量相关装置的质量.
步骤3:加热装置B直至装置C中无气泡产生.
步骤4:
步骤5:称量相关装置的质量.
①装置A的作用是
②某同学在实验过程中采集了如下数据:
A.反应前玻璃管与样品的质量163.8g
B.反应后玻璃管中残留固体质量56.0g
C.装置C实验后增重9.0g
D.装置D实验后增重8.8g
为测定x/y的值,你认为可以选用上述所采集数据中的
查看习题详情和答案>>
(1)孔雀石呈绿色,是一种名贵的宝石,其主要成分是Cu(OH)2?CuCO3.某兴趣小组为探究制取孔雀石的最佳反应条件,设计了如下实验:
实验1:将2.0mL 0.50mol?L-1的Cu(NO3)2溶液、2.0mL 0.50mol?L-1的NaOH溶液和0.25mol?L-1的Na2CO3溶液按表Ⅰ所示体积混合.
实验2:将合适比例的混合物在表Ⅱ所示温度下反应.
实验记录如下:
| 编号 | V (Na2CO3)/mL | 沉淀情况 | 编号 | 反应温度/℃ | 沉淀情况 | |
| 1 | 2.8 | 多、蓝色 | |
1 | 40 | 多、蓝色 |
| 2 | 2.4 | 多、蓝色 | 2 | 60 | 少、浅绿色 | |
| 3 | 2.0 | 较多、绿色 | 3 | 75 | 较多、绿色 | |
| 4 | 1.6 | 较少、绿色 | 4 | 80 | 较多、绿色(少量褐色) |
①实验室制取少许孔雀石,应该采用的条件是
n[Cu(NO3)2]:n(Na2CO3)=2:1、75℃
n[Cu(NO3)2]:n(Na2CO3)=2:1、75℃
.②80℃时,所制得的孔雀石有少量褐色物质的原因是
Cu(OH)2受热分解为CuO
Cu(OH)2受热分解为CuO
.(2)实验小组为测定上述某条件下所制得的碱式碳酸铜样品组成,利用下图所示的装置(夹持仪器省略)进行实验:

步骤1:检查装置的气密性,将过滤、洗涤并干燥过的样品置于平直玻璃管中.
步骤2:打开活塞K,鼓入空气,一段时间后关闭,称量相关装置的质量.
步骤3:加热装置B直至装置C中无气泡产生.
步骤4:
继续通一段时间空气至装置冷却
继续通一段时间空气至装置冷却
.步骤5:称量相关装置的质量.
①装置A的作用是
除去空气中的CO2和H2O
除去空气中的CO2和H2O
;若无装置E,则实验测定的x/y的值将偏小
偏小
(选填“偏大”、“偏小”或“无影响”).②某同学在实验过程中采集了如下数据:
A.反应前玻璃管与样品的质量163.8g
B.反应后玻璃管中残留固体质量56.0g
C.装置C实验后增重9.0g
D.装置D实验后增重8.8g
为测定x/y的值,你认为可以选用上述所采集数据中的
BC、BD、CD
BC、BD、CD
(写出所有组合的字母代号)一组即可进行计算,并根据你的计算结果,写出该样品组成的化学式5Cu(OH)2?2CuCO3
5Cu(OH)2?2CuCO3
.(2013?天津模拟)Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O.当产物n(NO2):n(NO)=1:1时,下列说法正确的是( )
查看习题详情和答案>>
 (2009?广东)铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂.
(2009?广东)铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂.(1)Cu位于元素周期表第I B族.Cu2+的核外电子排布式为
[Ar]3d9或1s22s22p63s23p63d9
[Ar]3d9或1s22s22p63s23p63d9
.(2)右图是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为
4
4
.(3)胆矾CuSO4?5H2O可写成[Cu(H2O4)]SO4?H2O,其结构示意图如下:

下列说法正确的是
ABD
ABD
(填字母).A.在上述结构示意图中,所有氧原子都采用sp3杂化
B.在上述结构示意图中,存在配位键、共价键和离子键
C.胆矾是分子晶体,分子间存在氢键
D.胆矾中的水在不同温度下会分步失去
(4)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子.已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是
F的电负性比N大,N-F成键电子对向F偏移,导致NF3中N原子核对其孤对电子的吸引能力增强,难以形成配位键,故NF3不易与Cu2+形成配离子(或者N、F、H三种元素的电负性:F>N>H,在NF3中,共用电子对偏向F,偏离N原子使得氮原子上的孤对电子难于与Cu2+形成配位键.)
F的电负性比N大,N-F成键电子对向F偏移,导致NF3中N原子核对其孤对电子的吸引能力增强,难以形成配位键,故NF3不易与Cu2+形成配离子(或者N、F、H三种元素的电负性:F>N>H,在NF3中,共用电子对偏向F,偏离N原子使得氮原子上的孤对电子难于与Cu2+形成配位键.)
.(5)Cu2O的熔点比Cu2S的
高
高
(填“高”或“低”),请解释原因Cu2O与Cu2S相比,阳离子相同、阴离子所带的电荷数也相同,但O2-半径比S2-半径小,所以Cu2O的晶格能更大,熔点更高
Cu2O与Cu2S相比,阳离子相同、阴离子所带的电荷数也相同,但O2-半径比S2-半径小,所以Cu2O的晶格能更大,熔点更高
.
二甲醚(DME)被誉为“21世纪的清洁燃料”.由合成气制备二甲醚的主要原理如下:
①CO(g)+2H2(g)?CH3OH(g)△H1=-90.7kJ?mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-23.5kJ?mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41.2kJ?mol-1
回答下列问题:
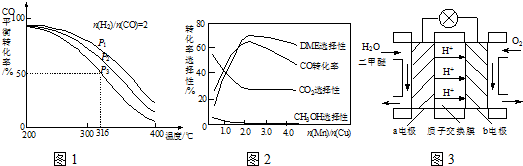
(1)则反应3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)的△H= kJ?mol-1.
(2)下列措施中,能提高CH3OCH3产率的有 .
A.使用过量的CO B.升高温度 C.增大压强
(3)反应③能提高CH3OCH3的产率,原因是 .
(4)将合成气以
=2通入1L的反应器中,一定条件下发生反应:
4H2(g)+2CO(g)?CH3OCH3(g)+H2O(g)△H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是 .
A.△H<0
B.P1<P2<P3
C.若在P3和316℃时,起始时
=3,则达到平衡时,CO转化率小于50%
(5)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2制备二甲醚.观察图2回答问题.催化剂中
约为 时最有利于二甲醚的合成.
(6)图3为绿色电源“二甲醚燃料电池”的工作原理示意图,a电极的电极反应式为 .
(7)甲醇液相脱水法制二甲醚的原理是:CH3OH+H2SO4→CH3HSO4+H2O,CH3HSO4+CH3OH→CH3OCH3+H2SO4.与合成气制备二甲醚比较,该工艺的优点是反应温度低,转化率高,其缺点是 .
查看习题详情和答案>>
①CO(g)+2H2(g)?CH3OH(g)△H1=-90.7kJ?mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-23.5kJ?mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41.2kJ?mol-1
回答下列问题:

(1)则反应3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)的△H=
(2)下列措施中,能提高CH3OCH3产率的有
A.使用过量的CO B.升高温度 C.增大压强
(3)反应③能提高CH3OCH3的产率,原因是
(4)将合成气以
| n(H2) |
| n(CO) |
4H2(g)+2CO(g)?CH3OCH3(g)+H2O(g)△H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是
A.△H<0
B.P1<P2<P3
C.若在P3和316℃时,起始时
| n(H2) |
| n(CO) |
(5)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2制备二甲醚.观察图2回答问题.催化剂中
| n(Mn) |
| n(Cu) |
(6)图3为绿色电源“二甲醚燃料电池”的工作原理示意图,a电极的电极反应式为
(7)甲醇液相脱水法制二甲醚的原理是:CH3OH+H2SO4→CH3HSO4+H2O,CH3HSO4+CH3OH→CH3OCH3+H2SO4.与合成气制备二甲醚比较,该工艺的优点是反应温度低,转化率高,其缺点是