摘要:10.已知293K时.2SO2(g) +O2(g)≒2SO3(g) ;△H= -197KJ/mol.在相同的温度下.向密闭 容器中通入2 mol SO2和1 mol O2.达到平衡时放出热暈Q1JK,向另一容积相同的容器中通入1 mol SO2和0.5 mol O2.达到平衡时放出热量Q2JK,则Q1.Q2满足的关系是( ) (A) 2 Q2= Q1 (B) 2 Q2< Q1 (C) Q2< Q1=197 (D) Q2=Q1<197
网址:http://m.1010jiajiao.com/timu3_id_398460[举报]
(2011?丰台区一模)工业生产中含硫废水的排放会污染环境,需要对含硫废水进行处理与利用.
(1)某制革厂含硫废水中主要含有物是Na2S.
①测得该废水溶液pH=12,用离子方程式解释溶液呈碱性的原因
②含硫废水的处理过程中可以采用纯氧将Na2S转化为Na2SO4,则反应中还原剂与氧化剂的物质的量之比为
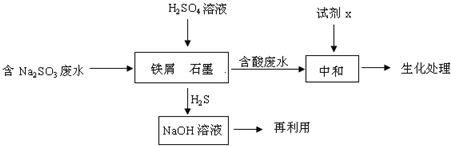
(2)含硫燃料中间体废水中主要含有物为Na2SO3,回收废水中的硫化物,以减少资源的浪费,可采用以下方法:
①中和含酸废水工业常用的试剂x是
②写出H2S气体与足量NaOH溶液反应的化学方程式
③铁屑与石墨能形成微型原电池,SO32-在酸性条件下放电生成H2S进入气相从而达到从废水中除去Na2SO3的目的,写出SO32-在酸性条件下放电生成H2S的电极反应式:
④已知:2H2S(g)+O2(g)=2S(s)+2H2O(l)△H=-632.8kJ/mol
SO2(g)=S(s)+O2(g)△H=+269.8kJ/mol
H2S与O2反应生成SO2和H2O的热化学方程式为
查看习题详情和答案>>
(1)某制革厂含硫废水中主要含有物是Na2S.
①测得该废水溶液pH=12,用离子方程式解释溶液呈碱性的原因
S2-+H2O HS-+OH-
HS-+OH-
 HS-+OH-
HS-+OH-S2-+H2O HS-+OH-
HS-+OH-
. HS-+OH-
HS-+OH-②含硫废水的处理过程中可以采用纯氧将Na2S转化为Na2SO4,则反应中还原剂与氧化剂的物质的量之比为
1:2
1:2
.已知1000℃时,硫酸钠与氢气发生下列反应:Na2SO4(s)+4H2(g)?Na2S(s)+4H2O(g),已知该反应的平衡常数K1000℃<K1400℃,则该反应的△H>
>
0(填“>”“=”或“<”).(2)含硫燃料中间体废水中主要含有物为Na2SO3,回收废水中的硫化物,以减少资源的浪费,可采用以下方法:
①中和含酸废水工业常用的试剂x是
石灰水
石灰水
.②写出H2S气体与足量NaOH溶液反应的化学方程式
H2S+2NaOH=Na2S+2H2O
H2S+2NaOH=Na2S+2H2O
.③铁屑与石墨能形成微型原电池,SO32-在酸性条件下放电生成H2S进入气相从而达到从废水中除去Na2SO3的目的,写出SO32-在酸性条件下放电生成H2S的电极反应式:
SO32-+8H++6e-=H2S↑+3H2O
SO32-+8H++6e-=H2S↑+3H2O
.④已知:2H2S(g)+O2(g)=2S(s)+2H2O(l)△H=-632.8kJ/mol
SO2(g)=S(s)+O2(g)△H=+269.8kJ/mol
H2S与O2反应生成SO2和H2O的热化学方程式为
2H2S(g)+3O2(g)=2SO2(g)+2H2O(l)△H=-1172.4kJ/mol
2H2S(g)+3O2(g)=2SO2(g)+2H2O(l)△H=-1172.4kJ/mol
.
工业生产中含硫废水的排放会污染环境,需要对含硫废水进行处理与利用.
(1)某制革厂含硫废水中主要含有物是Na2S.
①测得该废水溶液pH=12,用离子方程式解释溶液呈碱性的原因______.
②含硫废水的处理过程中可以采用纯氧将Na2S转化为Na2SO4,则反应中还原剂与氧化剂的物质的量之比为______.已知1000℃时,硫酸钠与氢气发生下列反应:Na2SO4(s)+4H2(g)?Na2S(s)+4H2O(g),已知该反应的平衡常数K1000℃<K1400℃,则该反应的△H______0(填“>”“=”或“<”).
(2)含硫燃料中间体废水中主要含有物为Na2SO3,回收废水中的硫化物,以减少资源的浪费,可采用以下方法:
①中和含酸废水工业常用的试剂x是______.
②写出H2S气体与足量NaOH溶液反应的化学方程式______.
③铁屑与石墨能形成微型原电池,SO32-在酸性条件下放电生成H2S进入气相从而达到从废水中除去Na2SO3的目的,写出SO32-在酸性条件下放电生成H2S的电极反应式:______.
④已知:2H2S(g)+O2(g)=2S(s)+2H2O(l)△H=-632.8kJ/mol
SO2(g)=S(s)+O2(g)△H=+269.8kJ/mol
H2S与O2反应生成SO2和H2O的热化学方程式为______.

查看习题详情和答案>>
工业生产中含硫废水的排放会污染环境,需要对含硫废水进行处理与利用.
(1)某制革厂含硫废水中主要含有物是Na2S.
①测得该废水溶液pH=12,用离子方程式解释溶液呈碱性的原因 .
②含硫废水的处理过程中可以采用纯氧将Na2S转化为Na2SO4,则反应中还原剂与氧化剂的物质的量之比为 .已知1000℃时,硫酸钠与氢气发生下列反应:Na2SO4(s)+4H2(g)?Na2S(s)+4H2O(g),已知该反应的平衡常数K1000℃<K1400℃,则该反应的△H 0(填“>”“=”或“<”).
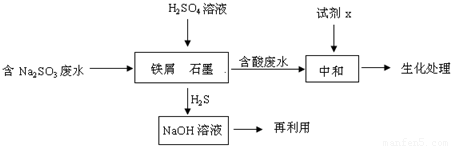
(2)含硫燃料中间体废水中主要含有物为Na2SO3,回收废水中的硫化物,以减少资源的浪费,可采用以下方法:
①中和含酸废水工业常用的试剂x是 .
②写出H2S气体与足量NaOH溶液反应的化学方程式 .
③铁屑与石墨能形成微型原电池,SO32-在酸性条件下放电生成H2S进入气相从而达到从废水中除去Na2SO3的目的,写出SO32-在酸性条件下放电生成H2S的电极反应式: .
④已知:2H2S(g)+O2(g)=2S(s)+2H2O(l)△H=-632.8kJ/mol
SO2(g)=S(s)+O2(g)△H=+269.8kJ/mol
H2S与O2反应生成SO2和H2O的热化学方程式为 .
 查看习题详情和答案>>
查看习题详情和答案>>
(1)某制革厂含硫废水中主要含有物是Na2S.
①测得该废水溶液pH=12,用离子方程式解释溶液呈碱性的原因 .
②含硫废水的处理过程中可以采用纯氧将Na2S转化为Na2SO4,则反应中还原剂与氧化剂的物质的量之比为 .已知1000℃时,硫酸钠与氢气发生下列反应:Na2SO4(s)+4H2(g)?Na2S(s)+4H2O(g),已知该反应的平衡常数K1000℃<K1400℃,则该反应的△H 0(填“>”“=”或“<”).
(2)含硫燃料中间体废水中主要含有物为Na2SO3,回收废水中的硫化物,以减少资源的浪费,可采用以下方法:
①中和含酸废水工业常用的试剂x是 .
②写出H2S气体与足量NaOH溶液反应的化学方程式 .
③铁屑与石墨能形成微型原电池,SO32-在酸性条件下放电生成H2S进入气相从而达到从废水中除去Na2SO3的目的,写出SO32-在酸性条件下放电生成H2S的电极反应式: .
④已知:2H2S(g)+O2(g)=2S(s)+2H2O(l)△H=-632.8kJ/mol
SO2(g)=S(s)+O2(g)△H=+269.8kJ/mol
H2S与O2反应生成SO2和H2O的热化学方程式为 .
 查看习题详情和答案>>
查看习题详情和答案>>
工业生产中含硫废水的排放会污染环境,需要对含硫废水进行处理与利用.
(1)某制革厂含硫废水中主要含有物是Na2S.
①测得该废水溶液pH=12,用离子方程式解释溶液呈碱性的原因________________.
②含硫废水的处理过程中可以采用纯氧将Na2S转化为Na2SO4,则反应中还原剂与氧化剂的物质的量之比为________.已知1000℃时,硫酸钠与氢气发生下列反应:
Na2SO4(s)+4H2(g)(2)含硫燃料中间体废水中主要含有物为Na2SO3,回收废水中的硫化物,以减少资源的浪费,可采用以下方法:

①
中和含酸废水工业常用的试剂x是________.②写出H2S气体与足量NaOH溶液反应的化学方程式________.
③铁屑与石墨能形成微型原电池,SO![]() 在酸性条件下放电生成H2S进入气相从而达到从废水中除去Na2SO3的目的,写出SO
在酸性条件下放电生成H2S进入气相从而达到从废水中除去Na2SO3的目的,写出SO![]() 在酸性条件下放电生成H2S的电极反应式:________.
在酸性条件下放电生成H2S的电极反应式:________.
④已知:2
H2S(g)+O2(g)=2S(s)+2H2O(l) ΔH=-632.8 kJ/molS
O2(g)=S(s)+O2(g) ΔH=+269.8 kJ/molH2S
与O2反应生成SO2和H2O的热化学方程式为________.有关钴、镍和铁化合物的性质见下表:
氯化钴可用于化学反应催化剂,油漆催干剂,干湿指示剂,啤酒泡沫稳定剂,陶瓷着色剂,制造隐显墨水等.用金属钴板(含少量Fe、Ni)制备氯化钴的工艺流程如下:
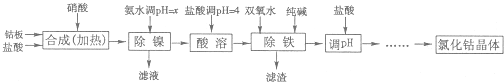
钴与盐酸反应极慢,需加入催化剂硝酸才可能进行实际生产.
(1)“除镍”步骤中,NH3?H2O用量对反应收率的影响,见下表:
从表中可知x=
(2)“除镍”步骤必须控制在一定的时间内完成,否则沉淀将有部分Co(OH)3生成,试写出反应的化学方程式
(3)“除铁”步骤中加入双氧水发生反应的离子方程式是
(4)“除铁”步骤中加入的纯碱作用是
(5)在“调pH“步骤中,加盐酸的作用是
(6)已知25℃时,Ksp[Fe(OH)3]=4.0×10-38,则该温度下反应Fe3++3H2O?Fe(OH)3+3H+的平衡常数为
查看习题详情和答案>>
| 化学式 | 沉淀完全时的pH | 钴镍性质 | ||
| Co(OH)2 | 9.4 | Co+2HCl=CoCl2+H2↑ Co2++2NH3?H2O=Co(OH)2↓+2NH
Ni+2HCl=NiCl2+H2↑ Co2++2H2O?Co(OH)2+2H+ Ni2++6NH3?H2O=[Ni(NH3)6]2++6H2O | ||
| Fe(OH)2 | 9.6 | |||
| Fe(OH)3 | 3.7 |

钴与盐酸反应极慢,需加入催化剂硝酸才可能进行实际生产.
(1)“除镍”步骤中,NH3?H2O用量对反应收率的影响,见下表:
| 加NH3?H2O调PH | 收率/% | Ni2+含量/% |
| 9 | 98.1 | 0.08 |
| 9.5 | 98 | 0.05 |
| 10 | 97.6 | 0.005 |
| 10.3 | 94 | 0.005 |
10
10
时,除镍效果最好.(2)“除镍”步骤必须控制在一定的时间内完成,否则沉淀将有部分Co(OH)3生成,试写出反应的化学方程式
4Co(OH)2+O2+2H2O=4Co(OH)3
4Co(OH)2+O2+2H2O=4Co(OH)3
.(3)“除铁”步骤中加入双氧水发生反应的离子方程式是
2Fe2++H2O2+2H+=2Fe3++2H2O
2Fe2++H2O2+2H+=2Fe3++2H2O
.(4)“除铁”步骤中加入的纯碱作用是
使得铁离子转化为氢氧化铁沉淀而除去
使得铁离子转化为氢氧化铁沉淀而除去
.(5)在“调pH“步骤中,加盐酸的作用是
防止Co2+水解
防止Co2+水解
.(6)已知25℃时,Ksp[Fe(OH)3]=4.0×10-38,则该温度下反应Fe3++3H2O?Fe(OH)3+3H+的平衡常数为
2.5×10-5
2.5×10-5
.