题目内容
(2011?丰台区一模)工业生产中含硫废水的排放会污染环境,需要对含硫废水进行处理与利用.
(1)某制革厂含硫废水中主要含有物是Na2S.
①测得该废水溶液pH=12,用离子方程式解释溶液呈碱性的原因
②含硫废水的处理过程中可以采用纯氧将Na2S转化为Na2SO4,则反应中还原剂与氧化剂的物质的量之比为
(2)含硫燃料中间体废水中主要含有物为Na2SO3,回收废水中的硫化物,以减少资源的浪费,可采用以下方法:
①中和含酸废水工业常用的试剂x是
②写出H2S气体与足量NaOH溶液反应的化学方程式
③铁屑与石墨能形成微型原电池,SO32-在酸性条件下放电生成H2S进入气相从而达到从废水中除去Na2SO3的目的,写出SO32-在酸性条件下放电生成H2S的电极反应式:
④已知:2H2S(g)+O2(g)=2S(s)+2H2O(l)△H=-632.8kJ/mol
SO2(g)=S(s)+O2(g)△H=+269.8kJ/mol
H2S与O2反应生成SO2和H2O的热化学方程式为

(1)某制革厂含硫废水中主要含有物是Na2S.
①测得该废水溶液pH=12,用离子方程式解释溶液呈碱性的原因
S2-+H2O HS-+OH-
HS-+OH-
 HS-+OH-
HS-+OH-S2-+H2O HS-+OH-
HS-+OH-
. HS-+OH-
HS-+OH-②含硫废水的处理过程中可以采用纯氧将Na2S转化为Na2SO4,则反应中还原剂与氧化剂的物质的量之比为
1:2
1:2
.已知1000℃时,硫酸钠与氢气发生下列反应:Na2SO4(s)+4H2(g)?Na2S(s)+4H2O(g),已知该反应的平衡常数K1000℃<K1400℃,则该反应的△H>
>
0(填“>”“=”或“<”).(2)含硫燃料中间体废水中主要含有物为Na2SO3,回收废水中的硫化物,以减少资源的浪费,可采用以下方法:
①中和含酸废水工业常用的试剂x是
石灰水
石灰水
.②写出H2S气体与足量NaOH溶液反应的化学方程式
H2S+2NaOH=Na2S+2H2O
H2S+2NaOH=Na2S+2H2O
.③铁屑与石墨能形成微型原电池,SO32-在酸性条件下放电生成H2S进入气相从而达到从废水中除去Na2SO3的目的,写出SO32-在酸性条件下放电生成H2S的电极反应式:
SO32-+8H++6e-=H2S↑+3H2O
SO32-+8H++6e-=H2S↑+3H2O
.④已知:2H2S(g)+O2(g)=2S(s)+2H2O(l)△H=-632.8kJ/mol
SO2(g)=S(s)+O2(g)△H=+269.8kJ/mol
H2S与O2反应生成SO2和H2O的热化学方程式为
2H2S(g)+3O2(g)=2SO2(g)+2H2O(l)△H=-1172.4kJ/mol
2H2S(g)+3O2(g)=2SO2(g)+2H2O(l)△H=-1172.4kJ/mol
.
分析:(1)①Na2S为强碱弱酸盐,S2-水解呈碱性;
②根据氧化还原反应中氧化剂和还原剂得失电子数目相等计算;温度升高平衡常数增大,说明升高温度平衡向正反应移动,则正反应吸热;
(2)①中和含酸废水工业常用廉价的石灰水;
②H2S气体与足量NaOH溶液反应反应生成Na2S和水;
③SO32-在酸性条件下放电生成H2S的过程为还原反应,根据反应物和生成物书写电极反应式;
④利用盖斯定律计算反应热,并写出热化学方程式.
②根据氧化还原反应中氧化剂和还原剂得失电子数目相等计算;温度升高平衡常数增大,说明升高温度平衡向正反应移动,则正反应吸热;
(2)①中和含酸废水工业常用廉价的石灰水;
②H2S气体与足量NaOH溶液反应反应生成Na2S和水;
③SO32-在酸性条件下放电生成H2S的过程为还原反应,根据反应物和生成物书写电极反应式;
④利用盖斯定律计算反应热,并写出热化学方程式.
解答:解:(1)①Na2S为强碱弱酸盐,S2-水解呈碱性,水解方程式为S2-+H2O HS-+OH-,
HS-+OH-,
故答案为:S2-+H2O HS-+OH-;
HS-+OH-;
②1molNa2S转化为1molNa2SO4,失去8mol电子,而1molO2被还原,得到4mol电子,所以还原剂与氧化剂的物质的量之比为1:2,温度升高平衡常数增大,说明升高温度平衡向正反应移动,则正反应吸热,即△H>O,
故答案为:1:2;>;
(2)①中和含酸废水工业常用廉价的石灰水,故答案为:石灰水;
②H2S气体与足量NaOH溶液反应反应生成Na2S和水,反应的化学方程式为H2S+2NaOH=Na2S+2H2O,
故答案为:H2S+2NaOH=Na2S+2H2O;
③SO32-在酸性条件下放电生成H2S的过程为还原反应,电极反应式为SO32-+8H++6e-=H2S↑+3H2O,
故答案为:SO32-+8H++6e-=H2S↑+3H2O;
④已知:①2H2S(g)+O2(g)=2S(s)+2H2O(l)△H=-632.8kJ/mol,
②SO2(g)=S(s)+O2(g)△H=+269.8kJ/mol,
利用盖斯定律将①-②×2可得:2H2S(g)+3O2(g)=2SO2(g)+2H2O(l),
对应的反应热为:△H=(-632.8kJ/mol)-2×(+269.8kJ/mol)=-1172.4kJ/mol,
所以热化学方程式为2H2S(g)+3O2(g)=2SO2(g)+2H2O(l)△H=-1172.4kJ/mol,
故答案为:2H2S(g)+3O2(g)=2SO2(g)+2H2O(l)△H=-1172.4kJ/mol.
 HS-+OH-,
HS-+OH-,故答案为:S2-+H2O
 HS-+OH-;
HS-+OH-;②1molNa2S转化为1molNa2SO4,失去8mol电子,而1molO2被还原,得到4mol电子,所以还原剂与氧化剂的物质的量之比为1:2,温度升高平衡常数增大,说明升高温度平衡向正反应移动,则正反应吸热,即△H>O,
故答案为:1:2;>;
(2)①中和含酸废水工业常用廉价的石灰水,故答案为:石灰水;
②H2S气体与足量NaOH溶液反应反应生成Na2S和水,反应的化学方程式为H2S+2NaOH=Na2S+2H2O,
故答案为:H2S+2NaOH=Na2S+2H2O;
③SO32-在酸性条件下放电生成H2S的过程为还原反应,电极反应式为SO32-+8H++6e-=H2S↑+3H2O,
故答案为:SO32-+8H++6e-=H2S↑+3H2O;
④已知:①2H2S(g)+O2(g)=2S(s)+2H2O(l)△H=-632.8kJ/mol,
②SO2(g)=S(s)+O2(g)△H=+269.8kJ/mol,
利用盖斯定律将①-②×2可得:2H2S(g)+3O2(g)=2SO2(g)+2H2O(l),
对应的反应热为:△H=(-632.8kJ/mol)-2×(+269.8kJ/mol)=-1172.4kJ/mol,
所以热化学方程式为2H2S(g)+3O2(g)=2SO2(g)+2H2O(l)△H=-1172.4kJ/mol,
故答案为:2H2S(g)+3O2(g)=2SO2(g)+2H2O(l)△H=-1172.4kJ/mol.
点评:本题考查较为综合,涉及盐类的水解、氧化还原反应、电化学以及化学反应与能量等问题,题目难度中等,本题注意把握水解的原理、氧化还原反应的计算以及电极反应式的书写等方法性的问题.

练习册系列答案
 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案
相关题目
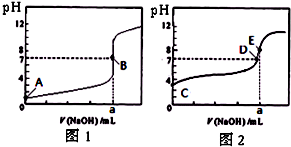 (2011?丰台区一模)常温下,用0.1000mol/L NaOH溶液分别滴定20.00mL 0.1000mol/L 盐酸和20.00mL 0.1000mol/L 醋酸溶液,得到2条滴定曲线,如图所示.若以HA表示酸,下列说法正确的是( )
(2011?丰台区一模)常温下,用0.1000mol/L NaOH溶液分别滴定20.00mL 0.1000mol/L 盐酸和20.00mL 0.1000mol/L 醋酸溶液,得到2条滴定曲线,如图所示.若以HA表示酸,下列说法正确的是( )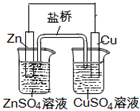 (2011?丰台区一模)下列叙述正确的是( )
(2011?丰台区一模)下列叙述正确的是( )