网址:http://m.1010jiajiao.com/timu3_id_397693[举报]
光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成。
(1)实验室中常用来制备氯气的化学方程式为 Mno2+4Hcl(浓)![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(2)工业上利用天然气(主要成分为CH4)与CO2进行高温重整制各CO,已知CH4、H2和CO的燃烧热(△H)分别为-890.3 kJ/mol、-285.8kJ/mol和-283.0 kJ/mol,则生成1 m3(标准状况)CO所需热量为__________;
(3)实验室中可用氯仿(CHCl3)与双氧水直接反应制备光气,其反应的化学方程式为________________;
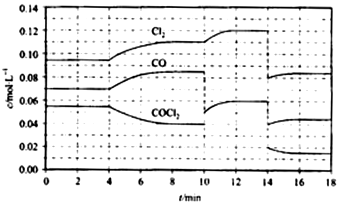
(4)COCl2的分解反应为COCl2(g) === Cl2(g) + CO(g) △H = +108 kJ/mol。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10 min到14 min的COCl2浓度变化曲线来示出):

①计算反应在第8 min时的平衡常数K = __________
②比较第2 min反应温度T(2)与第8 min反应温度(T8)的高低:T(2)____T(8)(填“<”、“>”或“=”);
③若12 min时反应于温度T(8)下重新达到平衡,则此时c(COCl2) = ______mol/L;
④比较产物CO在2~3 min、5~6 min和12~13 min时平均反应速率[平均反应速率分别以![]() (2—3)、
(2—3)、![]() (5—6)、
(5—6)、![]() (l2-13)表示]的大小____________;
(l2-13)表示]的大小____________;
⑤比较反应物COCl2在5-6 min和15-16 min时平均反应速率的大小:
![]() (5-6) >
(5-6) >![]() (15-16)(填“<”、“>”或“=”),原因是_______________。
(15-16)(填“<”、“>”或“=”),原因是_______________。
(1)实验室中常用来制备氯气的化学方程式为_________;
(2)工业上利用天然气(主要成分为CH4)与CO2进行高温重整制备CO,已知CH4、H2、和CO的燃烧热(△H)分别为-890.3kJ·mol-1、-285.8 kJ·mol-1和-283.0 kJ·mol-1,则生成1 m3
(标准状况)CO所需热量为___________;
(3)实验室中可用氯仿(CHCl3)与双氧水直接反应制备光气,其反应的化学方程式为___________;
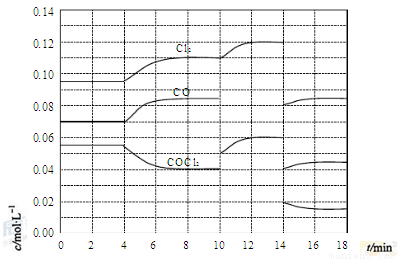
(4)COCl2的分解反应为COCl2(g)= Cl2(g)+ CO(g) △H=+108 kJ·mol-1。反应体系平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10min到14min的COCl2浓度变化曲线未示出):
②比较第2min反应温度T(2)与第8min反应温度T(8)的高低:T(2)___ T(8)(填“<”、“>”或“=” );
③若12min时反应与温度T(8)下重新达到平衡,则此时c(COCl2)=__mol·L-1
④比较产物CO在2-3min、5-6min和12-13min时平均反应速率[平均反应速率分别以v(2-3)、v(5-6)、v(12-13)表示]的大小________;
⑤比较反应物COCl2在5-6min和15-16min时平均反应速率的大小:v(5-6)___ v(15-16)(填“<”、“>”或“=”),原因是_______
(15分)光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成。
(1)实验室常用来制备氯气的化学方程式为 ;
(2)工业上利用天然气(主要成分为CH4)与CO2进行高温重整制备CO,已知CH4、H2、和CO的燃烧热(ΔH)分别为-890.3kJ·mol-1、-285.8kJ.mol-1和-283.0kJ.mol-1,则生成1m3(标准状况)CO所需热量为 ;
(3)实验室中可用氯仿(CHCl3)与双氧水直接反应制备光气,其反应的化学方程式为
;
(4)COCl2的分解反应为COCl2(g)=Cl2(g)+CO(g) ΔH=+108kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10min到14min的COCl2浓度变化曲线未示出):
①计算反应在第8min时的平衡常数K= ;
②比较第2min反应温度T(2)与第8min反应温度T(8)的高低:T(2) T(8)
(填“<”、“>”或“=”),
③若12min时反应于温度T(8)下重新达到平衡,则此时c(COCl2)= mol·L-1;
④比较产物CO在2-3min、5-6min和12-13min时平均反应速率(平均反应速率分别以v(2-3)、v(5-6)、v(12-13))的大小 ;
⑤比较反应物COCl2在5-6min和15-16min时平均反应速率的大小:v(5-6) v(15-16)(填“<”、“>”或“=”),原因是 。
查看习题详情和答案>>
(15分)光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成。
(1)实验室常用来制备氯气的化学方程式为 ;
(2)工业上利用天然气(主要成分为CH4)与CO2进行高温重整制备CO,已知CH4、H2、和CO的燃烧热(ΔH)分别为-890.3kJ·mol-1、-285.8kJ.mol-1和-283.0kJ.mol-1,则生成1m3(标准状况)CO所需热量为 ;
(3)实验室中可用氯仿(CHCl3)与双氧水直接反应制备光气,其反应的化学方程式为
;
(4)COCl2的分解反应为COCl2(g)=Cl2(g)+CO(g) ΔH=+108kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10min到14min的COCl2浓度变化曲线未示出):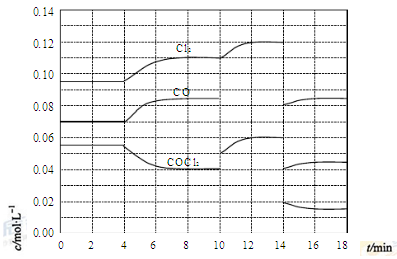
①计算反应在第8min时的平衡常数K= ;
②比较第2min反应温度T(2)与第8min反应温度T(8)的高低:T(2) T(8)
(填“<”、“>”或“=”),
③若12min时反应于温度T(8)下重新达到平衡,则此时c(COCl2)= mol·L-1;
④比较产物CO在2-3min、5-6min和12-13min时平均反应速率(平均反应速率分别以v(2-3)、v(5-6)、v(12-13))的大小 ;
⑤比较反应物COCl2在5-6min和15-16min时平均反应速率的大小:v(5-6) v(15-16)(填“<”、“>”或“=”),原因是 。
“氢能”被视为21世纪最具发展潜力的清洁能源。氢气的燃烧效率非常高,只要在汽油中加入4%的氢气,就可使内燃机节油40%。目前,氢能技术在美国、日本、欧盟等国家和地区已进入系统实施阶段。氢气的制取与储存是氢能源利用领域的研究热点。
已知:CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=206.2 kJ·mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=247.4 kJ·mol-1
2H2S(g)=2H2(g)+S2(g) ΔH=169.8 kJ·mol-1
(1)以甲烷为原料制取氢气是工业上常用的制氢方法。
CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为________。
(2)H2S热分解制氢气时,常向反应器中通入一定比例空气,使部分H2S燃烧,其目的是____________;燃烧生成的SO2与H2S进一步反应,生成物在常温下均为非气体,写出该反应的化学方程式:________________。
(3)H2O的热分解也可得到H2,高温下水分解体系中主要气体的体积分数与温度的关系如图1所示。图中A、B表示的物质依次是________。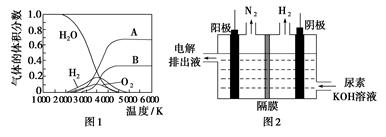
(4)电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图见图2(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。电解时,阳极的电极反应式为________________。
(5)Mg2Cu是一种储氢合金。350 ℃时,Mg2Cu与H2反应,生成MgCu2和仅含一种金属元素的氢化物(其中氢的质量分数为0.077)。Mg2Cu与H2反应的化学方程式为____________。