摘要:相邻A.B.C三种元素.A.B同周期.B.C同主族.三种元素核内质子数之总各为31.试推断三种元素的名称.
网址:http://m.1010jiajiao.com/timu3_id_3976705[举报]
X、Y、Z三种元素,原子序数依次减小。X是第四周期主族元素,其部分电离能如图所示;X、Y元素具有相同的最高正化合价;Z原子价电子排布式nsnnpn。回答下列问题:

(1)X原子的电子排布式为 。
(2)电负性:X Y(填“>”、“=”或“<”)。
(3)元素Z的一种氢化物(化学式为Z2H4)是重要的化工原料。 有关Z2H4分子的说法正确的是 (填字母)。
A.分子中含有氢键
B.属于非极性分子
C.含有4个σ键和1个π键
D.Z原子的杂化方式为sp2
(4)X的氧化物与钛(Ti)的氧化物相互作用,能形成钛酸盐,其晶体结构如图所示(X、Ti和O三种元素对应的离子分别位于立方体的体心、顶点和面心)。该晶体中,钛离子和周围 (填数字)个氧离子相紧邻。

(5)NH4Cl晶体中含有多种化学键,其中一定不含有的化学键是 (填字母)。
A.离子键 B.非极性键 C.配位键 D.金属键
查看习题详情和答案>>
A、B、C、D、E是短周期元素,周期表中A与B、B与C相邻,且C与E同主族;A与E的最外层电子数之比2:3,B的最外层电子数比C的最外层电子数少1个;常见化合物D2C2与水反应生成C的单质,且溶液使酚酞试液变红.
(1)E的元素名称是
(2)A、B、C的氢化物稳定性由弱到强的顺序为(用分子式表示)
(3)写出D2C2的电子式
 .用电子式表示只含D、E两种元素的化合物的形成过程
.用电子式表示只含D、E两种元素的化合物的形成过程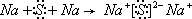
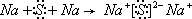
(4)写出D2C2与H2O反应的离子方程式
查看习题详情和答案>>
(1)E的元素名称是
硫
硫
.该元素在周期表中的位置为第三周期VIA族
第三周期VIA族
(2)A、B、C的氢化物稳定性由弱到强的顺序为(用分子式表示)
CH4<NH3<H2O
CH4<NH3<H2O
;B的氢化物和B的最高价氧化物的水化物反应生成Z,则Z中所含化学键的类型为离子键、极性键
离子键、极性键
(3)写出D2C2的电子式


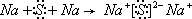
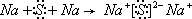
(4)写出D2C2与H2O反应的离子方程式
2Na2O2+2H2O=4Na++4OH-+O2↑
2Na2O2+2H2O=4Na++4OH-+O2↑
.A、B、C、D、E、F是原子序数依次增大的6种短周期元素.A、E同主族,B、C是同周期相邻的两种元素.A、C的质子数之和等于D的质子数,D2-与E+具有相同的电子层结构,D和F最外层电子数相同,F的最高正价与D的最低负价代数和等于4.试回答下列问题:
(1)常见化合物W由A、D、E三种元素组成,则W中含有的化学键类型有
(2)X、Y、Z三种常见化合物均有A、C、D三种元素组成,X和Z的水溶液呈酸性,Y的水溶液呈碱性,在溶液中,X促进水的电离,Y和Z抑制水的电离,则它们的化学式分别是:X
(3)用A2D2在酸性条件下处理含BC-的工业废水,将得到C2及BD2等无污染的物质,请写出该反应的离子方程式
查看习题详情和答案>>
(1)常见化合物W由A、D、E三种元素组成,则W中含有的化学键类型有
离子键、共价键
离子键、共价键
;(2)X、Y、Z三种常见化合物均有A、C、D三种元素组成,X和Z的水溶液呈酸性,Y的水溶液呈碱性,在溶液中,X促进水的电离,Y和Z抑制水的电离,则它们的化学式分别是:X
NH4NO3
NH4NO3
、YNH3?H2O
NH3?H2O
、ZHNO3
HNO3
;(3)用A2D2在酸性条件下处理含BC-的工业废水,将得到C2及BD2等无污染的物质,请写出该反应的离子方程式
5H2O2+2CN-+2H+═N2+2CO2+6H2O
5H2O2+2CN-+2H+═N2+2CO2+6H2O
.A、B、C、D四种元素处于同一周期.在同族元素中,A的气态氢化物沸点最高,B的最高价氧化物对应水化物的酸性在同周期中最强,C的电负性介于A、B之间,D与B相邻.
(1)C原子的价电子排布式为
(2)A、B、C三种原子的第一电离能由大到小的顺序是(写元素符号)
(3)B的单质分子中存在
(4)A的气态氢化物的沸点在同族中最高的原因
查看习题详情和答案>>
(1)C原子的价电子排布式为
2s22p4
2s22p4
.(2)A、B、C三种原子的第一电离能由大到小的顺序是(写元素符号)
F>N>O
F>N>O
.(3)B的单质分子中存在
2
2
个π键;B的气态氢化物BH3分子中的中心原子轨道采用sp3
sp3
杂化.B和D形成一种超硬、耐磨、耐高温的化合物,该化合物属于原子
原子
晶体,其硬度比金刚石大
大
(填“大”或“小”).(4)A的气态氢化物的沸点在同族中最高的原因
HF分子之间可以形成氢键从而使沸点升高
HF分子之间可以形成氢键从而使沸点升高
.