摘要:掌握同元素周期律解决实际问题的思路与方法
网址:http://m.1010jiajiao.com/timu3_id_39764[举报]
原子结构、元素周期律和周期表对于我们化学学习具有理论指导意义,下列有关说法正确的是
[ ]
A.同周期元素从左至右,原子半径逐渐减小,对应简单离子的半径逐渐增大。
B.可以根据主族元素原子的电子层数和最外层电子数确定其在周期表中的位置
C.由氟氯两元素在周期表中位置关系推知,氟元素非金属性强于氯元素,所以氢氟酸的酸性应强于盐酸
D.在实际生产中,多在元素周期表的过渡元素区寻找新型半导体材料
查看习题详情和答案>>
B.可以根据主族元素原子的电子层数和最外层电子数确定其在周期表中的位置
C.由氟氯两元素在周期表中位置关系推知,氟元素非金属性强于氯元素,所以氢氟酸的酸性应强于盐酸
D.在实际生产中,多在元素周期表的过渡元素区寻找新型半导体材料
应用元素周期律分析下列推断,其中正确的组合是( )
①铊(Tl)与铝同主族,其单质既能与盐酸反应,又能与氢氧化钠溶液反应
②气态氢化物的稳定性HF大于HCl
③硒(Be)的最高价氧化物对应水化物的酸性比硫酸弱
④第二周期非金属元素的气态氢化物溶于水后,水溶液均为酸性.
①铊(Tl)与铝同主族,其单质既能与盐酸反应,又能与氢氧化钠溶液反应
②气态氢化物的稳定性HF大于HCl
③硒(Be)的最高价氧化物对应水化物的酸性比硫酸弱
④第二周期非金属元素的气态氢化物溶于水后,水溶液均为酸性.
| A、①③ | B、②④ | C、①④ | D、②③ |
元素周期律和元素周期表是学习化学的重要工具,下列说法中,不正确的是( )
| A、HF、HCl、HBr、HI的还原性依次增强,热稳定性依次减弱 | B、P、S、Cl得电子能力和最高价氧化物对应水化物的酸性均依次增强 | C、IA族的金属单质与水反应比同周期IIA族的金属单质剧烈 | D、除稀有气体外,第三周期元素的原子半径和离子半径随原子序数的增加而减小 |
[化学选修-物质结构与性质]
元素周期律是20世纪科学技术发展的重要理论依据之一.已知A、B、C、D、E五种元素都是元素周期表中前20号元素.A、B、C、D四种元素在元素周期表(长式)中的相对位置如下图所示,B、C、D的最高价氧化物的水化物两两混合,均能发生反应生成盐和水.E元素的原子序数均大于A、B、C、D元素,且不与A、B、C、D元素位于同主族.
根据以上信息,回答下列问题:
(1)上述A、B、C、D四种元素中第一电离能最小的是 ,电负性最大的是 .(填相关元素的元素符号)
(2)A和D的氢化物中,沸点较高的是 (填相关物质的分子式);其原因是 .
(3)A和E可组成离子化合物,其晶胞(在晶体中具有代表性的最小重复单元)结构如下图所示:
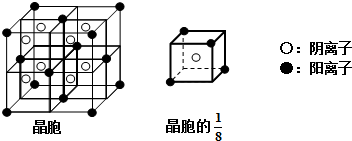
阳离子位于该正方体的顶点或面心;阴离子均位于小正方体中心.该化合物化学式为 .
查看习题详情和答案>>
元素周期律是20世纪科学技术发展的重要理论依据之一.已知A、B、C、D、E五种元素都是元素周期表中前20号元素.A、B、C、D四种元素在元素周期表(长式)中的相对位置如下图所示,B、C、D的最高价氧化物的水化物两两混合,均能发生反应生成盐和水.E元素的原子序数均大于A、B、C、D元素,且不与A、B、C、D元素位于同主族.
| … | A | |||||
| B | C | D |
(1)上述A、B、C、D四种元素中第一电离能最小的是
(2)A和D的氢化物中,沸点较高的是
(3)A和E可组成离子化合物,其晶胞(在晶体中具有代表性的最小重复单元)结构如下图所示:

阳离子位于该正方体的顶点或面心;阴离子均位于小正方体中心.该化合物化学式为