摘要:蒸发食盐溶液制食盐晶体时.应加热到( ) A.将水分蒸干 B.有少量晶体析出 C.有较多食盐晶体析出 D.蒸干后.继续加热一段时间
网址:http://m.1010jiajiao.com/timu3_id_3974920[举报]
食盐是维持人体正常生理活动的重要物质,同时也是重要的化工原料.
(1)小点同学用含杂质的食盐(杂质不溶于水)和蒸馏水配制50g 5%的氯化钠溶液,可能涉及以下过程及仪器:
①称量,②过滤,③蒸发结晶,④计算,⑤溶解.
①正确的操作顺序是______(填序号);除了用到铁架台、铁圈和上述提供的仪器外,还缺少的仪器是______(填名称).
②如果配制的溶液中NaCl的质量分数小于5%,则可能造成误差的实验操作原因有(写两点):
(Ⅰ)______;(Ⅱ)______.
(2)工业上常用氯化钠等原料制取烧碱,由于种种原因导致烧碱样品含有碳酸钠、硫酸钠和氯化钠.某学生为了检验其成分,按照如下图所示步骤进行实验,请将所加试剂及有关结论写在相应的空格中(有关物质用化学式表示).
(14分)某校化学兴趣小组欲对食盐的用途进行探究,获得以下信息并对相关问题进行研究。
一、用途之一:作调味品。
食盐的主要成份是NaCl, 通过晾晒海水或煮盐井水、盐湖水等,可以蒸发除去水分得到粗盐.粗盐中含有难溶性杂质(泥沙等)和多种可溶性杂质(氯化镁、氯化钙等).
[提出问题]如何才能将粗盐中难溶性杂质和可溶性杂质(氯化镁、氯化钙)除去,从而获得较纯的食盐晶体?
[资料准备]
| 20℃时,一些物质的溶解度 | ||
| | OH- | CO32- |
| Na+ | 溶 | 溶 |
| Ca2+ | 微 | 不 |
| Mg2+ | 不 | 微 |
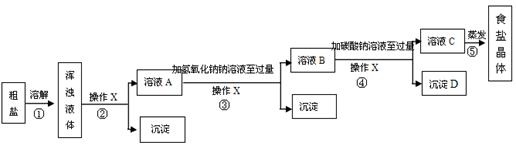
[实验方案]某同学为了提纯粗盐,设计了如下实验方案并进行实验.
[交流与表达]
(1)实验操作X的名称是 ,该操作中要用到的玻璃仪器有烧杯、玻璃棒和 。
(2)实验步骤③的主要目的是 (用化学方程式回答);判断氢氧化钠溶液已过量的方法是 。
(3)有同学认为原实验方案不完善,做出这种评价的依据是 。
二、用途之二:制备氯气。
工业上用电解饱和食盐水来制备氯气,可以得到多种化工产品,除氯气(Cl2)外,还生成密度最小的气体,向反应后的溶液中滴加无色酚酞试液,溶液变红,请写出发生反应的化学方程式 。
三、用途之三:工业制碱。
某厂采用“侯氏制碱法”生产化工产品——纯碱(Na2CO3)和化肥NH4Cl。
【相关资料】
⑴ NH4Cl△NH3↑+HCl↑
⑵已知20℃时有关物质的溶解度如下(气体指1体积水中能溶解的气体体积)
| 物质 | NaCl | NaHCO3 | NH4Cl | NH3 | CO2 |
| 溶解度 | 36.0g | 9.6g | 37.2g | 710 | 0.9 |
【生产流程】如下
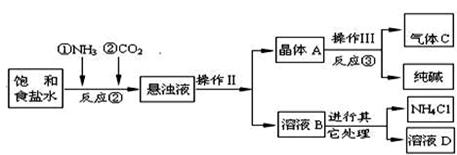
【问题讨论】:
(1)反应③中得到纯碱的化学方程式为: 。
(2)检验气体C的方法 。
(3)在反应②中,先通 气体,目的是 。
【组成确定】
(1)称取一定质量的纯碱样品,经多次充分加热后,再称重,质量无变化;
(2)另取少量纯碱样品加入适量水,样品完全溶解,向该溶液中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀。由上述实验可确定纯碱样品含有杂质 (写化学式)。
【含量测定】
称取纯碱样品10.8g加入适量水,再加入过量CaCl2溶液,搅拌、过滤、洗涤、干燥后称得固体质量为10.0g,请通过计算判断此纯碱样品的纯度为 。(保留一位小数)
【总结反思】
某同学认为,在上述纯碱含量测定中,将CaCl2溶液改为BaCl2溶液,测定误差会减小,其理由是 。 查看习题详情和答案>>
(14分)某校化学兴趣小组欲对食盐的用途进行探究,获得以下信息并对相关问题进行研究。
一、用途之一:作调味品。
食盐的主要成份是NaCl, 通过晾晒海水或煮盐井水、盐湖水等,可以蒸发除去水分得到粗盐.粗盐中含有难溶性杂质(泥沙等)和多种可溶性杂质(氯化镁、氯化钙等).
[提出问题]如何才能将粗盐中难溶性杂质和可溶性杂质(氯化镁、氯化钙)除去,从而获得较纯的食盐晶体?
[资料准备]

[实验方案]某同学为了提纯粗盐,设计了如下实验方案并进行实验.
[交流与表达]
(1)实验操作X的名称是 ,该操作中要用到的玻璃仪器有烧杯、玻璃棒和 。
(2)实验步骤③的主要目的是 (用化学方程式回答);判断氢氧化钠溶液已过量的方法是 。
(3)有同学认为原实验方案不完善,做出这种评价的依据是 。
二、用途之二:制备氯气。
工业上用电解饱和食盐水来制备氯气,可以得到多种化工产品,除氯气(Cl2)外,还生成密度最小的气体,向反应后的溶液中滴加无色酚酞试液,溶液变红,请写出发生反应的化学方程式 。
三、用途之三:工业制碱。
某厂采用“侯氏制碱法”生产化工产品——纯碱(Na2CO3)和化肥NH4Cl。
【相关资料】
⑴ NH4Cl△NH3↑+HCl↑
⑵已知20℃时有关物质的溶解度如下(气体指1体积水中能溶解的气体体积)
【生产原理】是:将NH3和CO2通入饱和食盐水中得到NaHCO3和NH4Cl的混合物,反应的化学方程式为: ;分离出NaHCO3,加热制得纯碱。
【生产流程】如下

【问题讨论】:
(1)反应③中得到纯碱的化学方程式为: 。
(2)检验气体C的方法 。
(3)在反应②中,先通 气体,目的是 。
【组成确定】
(1)称取一定质量的纯碱样品,经多次充分加热后,再称重,质量无变化;
(2)另取少量纯碱样品加入适量水,样品完全溶解,向该溶液中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀。由上述实验可确定纯碱样品含有杂质 (写化学式)。
【含量测定】
称取纯碱样品10.8g加入适量水,再加入过量CaCl2溶液,搅拌、过滤、洗涤、干燥后称得固体质量为10.0g,请通过计算判断此纯碱样品的纯度为 。(保留一位小数)
【总结反思】
某同学认为,在上述纯碱含量测定中,将CaCl2溶液改为BaCl2溶液,测定误差会减小,其理由是 。
一、用途之一:作调味品。
食盐的主要成份是NaCl, 通过晾晒海水或煮盐井水、盐湖水等,可以蒸发除去水分得到粗盐.粗盐中含有难溶性杂质(泥沙等)和多种可溶性杂质(氯化镁、氯化钙等).
[提出问题]如何才能将粗盐中难溶性杂质和可溶性杂质(氯化镁、氯化钙)除去,从而获得较纯的食盐晶体?
[资料准备]
| 20℃时,一些物质的溶解度 | ||
| | OH- | CO32- |
| Na+ | 溶 | 溶 |
| Ca2+ | 微 | 不 |
| Mg2+ | 不 | 微 |

[实验方案]某同学为了提纯粗盐,设计了如下实验方案并进行实验.
[交流与表达]
(1)实验操作X的名称是 ,该操作中要用到的玻璃仪器有烧杯、玻璃棒和 。
(2)实验步骤③的主要目的是 (用化学方程式回答);判断氢氧化钠溶液已过量的方法是 。
(3)有同学认为原实验方案不完善,做出这种评价的依据是 。
二、用途之二:制备氯气。
工业上用电解饱和食盐水来制备氯气,可以得到多种化工产品,除氯气(Cl2)外,还生成密度最小的气体,向反应后的溶液中滴加无色酚酞试液,溶液变红,请写出发生反应的化学方程式 。
三、用途之三:工业制碱。
某厂采用“侯氏制碱法”生产化工产品——纯碱(Na2CO3)和化肥NH4Cl。
【相关资料】
⑴ NH4Cl△NH3↑+HCl↑
⑵已知20℃时有关物质的溶解度如下(气体指1体积水中能溶解的气体体积)
| 物质 | NaCl | NaHCO3 | NH4Cl | NH3 | CO2 |
| 溶解度 | 36.0g | 9.6g | 37.2g | 710 | 0.9 |
【生产流程】如下

【问题讨论】:
(1)反应③中得到纯碱的化学方程式为: 。
(2)检验气体C的方法 。
(3)在反应②中,先通 气体,目的是 。
【组成确定】
(1)称取一定质量的纯碱样品,经多次充分加热后,再称重,质量无变化;
(2)另取少量纯碱样品加入适量水,样品完全溶解,向该溶液中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀。由上述实验可确定纯碱样品含有杂质 (写化学式)。
【含量测定】
称取纯碱样品10.8g加入适量水,再加入过量CaCl2溶液,搅拌、过滤、洗涤、干燥后称得固体质量为10.0g,请通过计算判断此纯碱样品的纯度为 。(保留一位小数)
【总结反思】
某同学认为,在上述纯碱含量测定中,将CaCl2溶液改为BaCl2溶液,测定误差会减小,其理由是 。
某兴趣小组进行粗盐提纯并配制NaCl溶液,请回答下列问题:
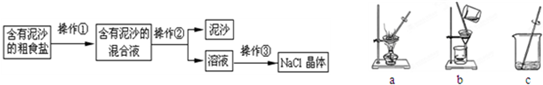
(1)操作①、②、③依次为图中的(填字母)
(2)若NaCl的产率偏低( 产率=
×100%),则可能的原因是(填字母)
A.过滤时滤纸有破损 B.蒸发时有固体溅出 C.溶解含有泥沙的粗食盐时,加入的水量不足
(3)用上述实验所得NaCl晶体配制8% NaCl溶液60.0g,常按以下操作顺序进行.
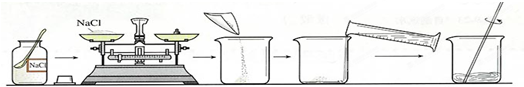
请回答下列问题:
①计算:需要氯化钠
②用托盘天平称量所需的氯化钠时,发现托盘天平的指针偏向左盘,应
A.增加适量氯化钠固体 B.减少适量氯化钠固体 C.调节平衡螺母D.移动游码
③下列操作,不会引起溶液中氯化钠的质量分数偏小的是
A.用量筒量取水时仰视读数 B.配制溶液时,烧杯先用少量蒸馏水润洗
C.氯化钠晶体不纯 D.转移已配好的溶液时,有少量溶液溅出.
查看习题详情和答案>>

(1)操作①、②、③依次为图中的(填字母)
c
c
、b、a
a
.(2)若NaCl的产率偏低( 产率=
| 所得晶体的质量 | 所取样品的质量 |
BC
BC
.A.过滤时滤纸有破损 B.蒸发时有固体溅出 C.溶解含有泥沙的粗食盐时,加入的水量不足
(3)用上述实验所得NaCl晶体配制8% NaCl溶液60.0g,常按以下操作顺序进行.

请回答下列问题:
①计算:需要氯化钠
4.8
4.8
g,水55.2
55.2
g.②用托盘天平称量所需的氯化钠时,发现托盘天平的指针偏向左盘,应
BC
BC
.A.增加适量氯化钠固体 B.减少适量氯化钠固体 C.调节平衡螺母D.移动游码
③下列操作,不会引起溶液中氯化钠的质量分数偏小的是
D
D
A.用量筒量取水时仰视读数 B.配制溶液时,烧杯先用少量蒸馏水润洗
C.氯化钠晶体不纯 D.转移已配好的溶液时,有少量溶液溅出.