题目内容
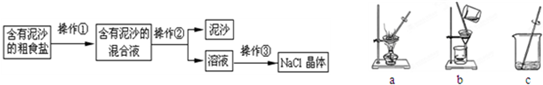
(1)操作①、②、③依次为图中的(填字母)
(2)若NaCl的产率偏低( 产率=
| 所得晶体的质量 | 所取样品的质量 |
A.过滤时滤纸有破损 B.蒸发时有固体溅出 C.溶解含有泥沙的粗食盐时,加入的水量不足
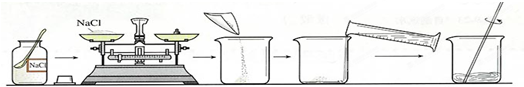
(3)用上述实验所得NaCl晶体配制8% NaCl溶液60.0g,常按以下操作顺序进行.
请回答下列问题:
①计算:需要氯化钠
②用托盘天平称量所需的氯化钠时,发现托盘天平的指针偏向左盘,应
A.增加适量氯化钠固体 B.减少适量氯化钠固体 C.调节平衡螺母D.移动游码
③下列操作,不会引起溶液中氯化钠的质量分数偏小的是
A.用量筒量取水时仰视读数 B.配制溶液时,烧杯先用少量蒸馏水润洗
C.氯化钠晶体不纯 D.转移已配好的溶液时,有少量溶液溅出.
(2)若NaCl的产率偏低,可能原因:蒸发时有固体溅出,溶解含有泥沙的粗食盐时,加入的水量不足,可以据此解答;
(3)①根据溶质的质量分数的计算公式进行计算;
②根据天平的使用方法来解答;
③根据溶质的质量分数的计算公式可以知道,若质量分数偏小,则溶质少了,或是溶剂多了,可以据此解答.
操作为图中相对应的为:a、液体蒸发,b、过滤,c、溶解.所以操作①与c对应,操作②与b对应,操作③与a对应;
(2)若NaCl的产率偏低,可能原因:蒸发时有固体溅出;溶解含有泥沙的粗盐时,加入的水量不足蒸发时有固体溅出,故选BC;
(3)①根据溶质的质量分数的计算公式可以知道:配制60.0g8% NaCl溶液需溶质的质量为:60.0g×8%=4.8g,需水的质量为:60.0g-4.8g=55.2g;
②用托盘天平称量所需的氯化钠时,发现托盘天平的指针偏向左盘,根据左物右码可以知道,加入的氯化钠偏多,所以应该减少适量的氯化钠固体,故选B;
③A、用量筒量取水时仰视读数,则会使量取的液体偏大,从而使溶质的质量分数减小,故A错误;
B、配制溶液时,烧杯先用少量蒸馏水润洗,会使溶剂的质量增加,从而使溶质的质量分数减小,故B错误;
C、氯化钠晶体不纯,则使溶质的质量偏小,所以配制的溶液的溶质的质量分数也会偏小,故C错误;
D、溶液具有均一性和稳定性,所以转移已配好的溶液时,有少量溶液溅出,不会影响溶质的质量分数,故D正确;
故选D.
故答案为:(1)c;a;
(2)BC;
(3)①4.8g;55.2g;
②BC;
③D.

兴趣小组参观某制碱厂后,获得以下信息并对相关问题进行研究.
【查阅资料】
①粗盐中含有少量可溶性杂质(MgCl2和CaCl2)及不溶性杂质.
②反应原理:NaCl(饱和)+NH3+CO2+H2O=NaHCO3↓+NH4Cl,将分离出的晶体A充分加热,可制得纯碱.
③NH4Cl NH3↑+HCl↑.
NH3↑+HCl↑.
④无水硫酸铜遇水变蓝
⑤部分生产流程如下图所示:
【问题讨论】
(1)①写出加入氢氧化钠溶液所发生反应的化学方程式______.
②操作Ⅱ的名称为______.
③反应(1)中加适量盐酸的作用是______.
④反应(2)中为提高产率,所加气体的顺序是______(填字母).
A.先通入二氧化碳再通氨气 B.先通入氨气再通二氧化碳
(2)上述生产流程中不可循环使用的是______(填字母).
A.CO2 B.NH3 C.HCl D.NaOH
【组成探究一】
(3)①晶体A受热分解的化学方程式为______.
②设计实验检验纯碱样品中是否混有晶体A请完成下表:
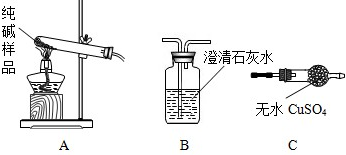
| 选择的装置 | 实验现象 | 实验结论 |
| ______ | ______ | 样品不含晶体A |
(4)取纯碱样品加水溶解,向其中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀.产生沉淀的方程式为______,确定纯碱样品含有杂质NaCl.
【组成探究三】
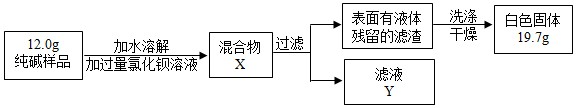
(5)同学们为了测定该纯碱样品的纯度,设计了如下实验:

①判断加入BaCl2溶液是否过量的合适方法是______,观察现象判断.
A.静置混合物X,向上层清液中再滴BaCl2溶液
B.向滤液Y中滴加BaCl2溶液
②判断滤渣是否洗涤干净,可采取向洗涤液中滴加______,观察现象判断.
A.BaCl2溶液 B.稀H2SO4 C.Na2CO3溶液 D.稀HCl
③根据实验数据,计算样品中碳酸钠的质量分数为______ (写出计算过程)
兴趣小组参观某制碱厂后,获得以下信息并对相关问题进行研究.
【查阅资料】
①粗盐中含有少量可溶性杂质(MgCl2和CaCl2)及不溶性杂质.
②反应原理:NaCl(饱和)+NH3+CO2+H2O=NaHCO3↓+NH4Cl,将分离出的晶体A充分加热,可制得纯碱.
③NH4Cl NH3↑+HCl↑.
NH3↑+HCl↑.
④无水硫酸铜遇水变蓝
⑤部分生产流程如下图所示:

【问题讨论】
(1)①写出加入氢氧化钠溶液所发生反应的化学方程式 ; .
②操作Ⅱ的名称为 .
③反应(1)中加适量盐酸的作用是 .
④反应(2)中为提高产率,所加气体的顺序是 (填字母).
A.先通入二氧化碳再通氨气 B.先通入氨气再通二氧化碳
(2)上述生产流程中不可循环使用的是 (填字母).
A.CO2 B.NH3 C.HCl D.NaOH
【组成探究一】
(3)①晶体A受热分解的化学方程式为 ; .
②设计实验检验纯碱样品中是否混有晶体A请完成下表:

| 选择的装置 | 实验现象 | 实验结论 |
|
|
| 样品不含晶体A |
【组成探究二】
(4)取纯碱样品加水溶解,向其中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀.产生沉淀的方程式为 ,确定纯碱样品含有杂质NaCl.
【组成探究三】
(5)同学们为了测定该纯碱样品的纯度,设计了如下实验:

①判断加入BaCl2溶液是否过量的合适方法是 ,观察现象判断.
A.静置混合物X,向上层清液中再滴BaCl2溶液
B.向滤液Y中滴加BaCl2溶液
②判断滤渣是否洗涤干净,可采取向洗涤液中滴加 ,观察现象判断.
A.BaCl2溶液 B.稀H2SO4 C.Na2CO3溶液 D.稀HCl
③根据实验数据,计算样品中碳酸钠的质量分数为 (写出计算过程)
【查阅资料】
①粗盐中含有少量可溶性杂质(MgCl2和CaCl2)及不溶性杂质.
②反应原理:NaCl(饱和)+NH3+CO2+H2O=NaHCO3↓+NH4Cl,将分离出的晶体A充分加热,可制得纯碱.
③NH4Cl
 NH3↑+HCl↑.
NH3↑+HCl↑.④无水硫酸铜遇水变蓝
⑤部分生产流程如下图所示:

【问题讨论】
(1)①写出加入氢氧化钠溶液所发生反应的化学方程式 .
②操作Ⅱ的名称为 .
③反应(1)中加适量盐酸的作用是 .
④反应(2)中为提高产率,所加气体的顺序是 (填字母).
A.先通入二氧化碳再通氨气 B.先通入氨气再通二氧化碳
(2)上述生产流程中不可循环使用的是 (填字母).
A.CO2 B.NH3 C.HCl D.NaOH
【组成探究一】
(3)①晶体A受热分解的化学方程式为 .
②设计实验检验纯碱样品中是否混有晶体A请完成下表:

| 选择的装置 | 实验现象 | 实验结论 |
| 样品不含晶体A |
(4)取纯碱样品加水溶解,向其中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀.产生沉淀的方程式为 ,确定纯碱样品含有杂质NaCl.
【组成探究三】
(5)同学们为了测定该纯碱样品的纯度,设计了如下实验:

①判断加入BaCl2溶液是否过量的合适方法是 ,观察现象判断.
A.静置混合物X,向上层清液中再滴BaCl2溶液
B.向滤液Y中滴加BaCl2溶液
②判断滤渣是否洗涤干净,可采取向洗涤液中滴加 ,观察现象判断.
A.BaCl2溶液 B.稀H2SO4 C.Na2CO3溶液 D.稀HCl
③根据实验数据,计算样品中碳酸钠的质量分数为 (写出计算过程)
【查阅资料】
①粗盐中含有少量可溶性杂质(MgCl2和CaCl2)及不溶性杂质.
②反应原理:NaCl(饱和)+NH3+CO2+H2O=NaHCO3↓+NH4Cl,将分离出的晶体A充分加热,可制得纯碱.
③NH4Cl
 NH3↑+HCl↑.
NH3↑+HCl↑.④无水硫酸铜遇水变蓝
⑤部分生产流程如下图所示:

【问题讨论】
(1)①写出加入氢氧化钠溶液所发生反应的化学方程式 .
②操作Ⅱ的名称为 .
③反应(1)中加适量盐酸的作用是 .
④反应(2)中为提高产率,所加气体的顺序是 (填字母).
A.先通入二氧化碳再通氨气 B.先通入氨气再通二氧化碳
(2)上述生产流程中不可循环使用的是 (填字母).
A.CO2 B.NH3 C.HCl D.NaOH
【组成探究一】
(3)①晶体A受热分解的化学方程式为 .
②设计实验检验纯碱样品中是否混有晶体A请完成下表:

| 选择的装置 | 实验现象 | 实验结论 |
| 样品不含晶体A |
(4)取纯碱样品加水溶解,向其中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀.产生沉淀的方程式为 ,确定纯碱样品含有杂质NaCl.
【组成探究三】
(5)同学们为了测定该纯碱样品的纯度,设计了如下实验:

①判断加入BaCl2溶液是否过量的合适方法是 ,观察现象判断.
A.静置混合物X,向上层清液中再滴BaCl2溶液
B.向滤液Y中滴加BaCl2溶液
②判断滤渣是否洗涤干净,可采取向洗涤液中滴加 ,观察现象判断.
A.BaCl2溶液 B.稀H2SO4 C.Na2CO3溶液 D.稀HCl
③根据实验数据,计算样品中碳酸钠的质量分数为 (写出计算过程)