题目内容
食盐是维持人体正常生理活动的重要物质,同时也是重要的化工原料.
(1)小点同学用含杂质的食盐(杂质不溶于水)和蒸馏水配制50g 5%的氯化钠溶液,可能涉及以下过程及仪器:
①称量,②过滤,③蒸发结晶,④计算,⑤溶解.
①正确的操作顺序是______(填序号);除了用到铁架台、铁圈和上述提供的仪器外,还缺少的仪器是______(填名称).
②如果配制的溶液中NaCl的质量分数小于5%,则可能造成误差的实验操作原因有(写两点):
(Ⅰ)______;(Ⅱ)______.
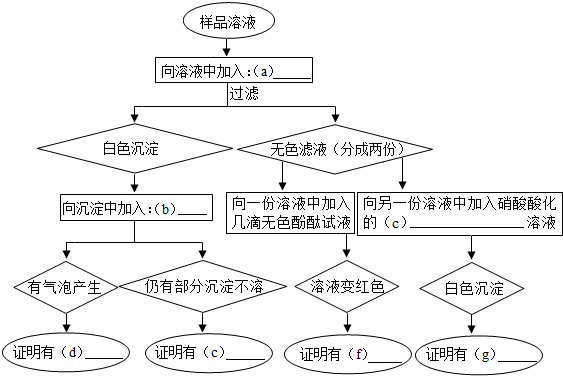
(2)工业上常用氯化钠等原料制取烧碱,由于种种原因导致烧碱样品含有碳酸钠、硫酸钠和氯化钠.某学生为了检验其成分,按照如下图所示步骤进行实验,请将所加试剂及有关结论写在相应的空格中(有关物质用化学式表示).
解:(1)食盐中的杂质除掉得到纯氯化钠,需要通过溶解、过滤、蒸发把不溶性的杂质去掉,再通过计算求出需要氯化钠质量,再称量出氯化钠进行量取和溶解;在蒸发时还需要蒸发皿、坩埚钳、石棉网;引起溶液中氯化钠的质量分数偏小,从两个方面考虑:①溶质少了(称量时左码右物并移动了游码、药品中含有杂质等)②水量多了(量水时仰视读数,烧杯中原来有水等);
(2)通过加入a得到两种沉淀,一种不溶于酸,一种溶于酸并产生气体,又因为不溶于酸的沉淀有硫酸钡和氯化银,而杂质中没有银离子,所以不溶于酸的沉淀是硫酸钡,所以加入的物质a是氢氧化钡,不溶于酸的沉淀是硫酸钡,所以证明样品中含有硫酸根离子,另一种溶于酸的沉淀是碳酸钡,所以样品中含有碳酸根离子,所以d是碳酸钠,e是硫酸钠,滴入酚酞变红说明溶液显碱性,含有氢氧化钠,另一种溶液中加入硝酸酸化的溶液产生白色沉淀,说明该沉淀不溶于硝酸,所以为氯化银沉淀,所以加入的c是硝酸银溶液,所以证明样品中含有氯离子,即含有氯化钠.
故答案为:
(1)⑤②③④①⑤;蒸发皿、坩埚钳、石棉网;(Ⅰ)仰视读数量取水;(Ⅱ)称量食盐时左码右物;
(2)a:Ba(OH)2;b:HNO3;c:AgNO3;d:Na2CO3;e:Na2SO4;f:NaOH;g:NaCl
分析:(1)先把食盐中的杂质除掉再配制溶液,仪器要根据溶解、过滤、蒸发中用到的仪器来考虑;如果配制的溶液中NaCl的质量分数小于5%,要从溶质可能少了和溶剂可能量多了考虑;
(2)沉淀加入酸后溶解并产生气体的沉淀是碳酸盐沉淀,不溶于硝酸的沉淀是硫酸钡沉淀或氯化银沉淀,再根据实际情况进行进一步分析.
点评:回答本题的关键是要知道不溶于硝酸的沉淀有硫酸钡和氯化银,沉淀溶于水并且产生气体一般是碳酸盐沉淀.
(2)通过加入a得到两种沉淀,一种不溶于酸,一种溶于酸并产生气体,又因为不溶于酸的沉淀有硫酸钡和氯化银,而杂质中没有银离子,所以不溶于酸的沉淀是硫酸钡,所以加入的物质a是氢氧化钡,不溶于酸的沉淀是硫酸钡,所以证明样品中含有硫酸根离子,另一种溶于酸的沉淀是碳酸钡,所以样品中含有碳酸根离子,所以d是碳酸钠,e是硫酸钠,滴入酚酞变红说明溶液显碱性,含有氢氧化钠,另一种溶液中加入硝酸酸化的溶液产生白色沉淀,说明该沉淀不溶于硝酸,所以为氯化银沉淀,所以加入的c是硝酸银溶液,所以证明样品中含有氯离子,即含有氯化钠.
故答案为:
(1)⑤②③④①⑤;蒸发皿、坩埚钳、石棉网;(Ⅰ)仰视读数量取水;(Ⅱ)称量食盐时左码右物;
(2)a:Ba(OH)2;b:HNO3;c:AgNO3;d:Na2CO3;e:Na2SO4;f:NaOH;g:NaCl
分析:(1)先把食盐中的杂质除掉再配制溶液,仪器要根据溶解、过滤、蒸发中用到的仪器来考虑;如果配制的溶液中NaCl的质量分数小于5%,要从溶质可能少了和溶剂可能量多了考虑;
(2)沉淀加入酸后溶解并产生气体的沉淀是碳酸盐沉淀,不溶于硝酸的沉淀是硫酸钡沉淀或氯化银沉淀,再根据实际情况进行进一步分析.
点评:回答本题的关键是要知道不溶于硝酸的沉淀有硫酸钡和氯化银,沉淀溶于水并且产生气体一般是碳酸盐沉淀.

练习册系列答案
相关题目