摘要:20. ② 各物质间的转化关系 A.B.C.D.E.F.G是由短周期元素组成的七种物质.其中B.C.F是单质,常温下B.C.E为气体,A物质的焰色反应呈黄色.(下图中反应②的部分产物未表示出来.) 根据上图所示转化关系回答: (1)经测定G属于离子化合物.其电子式为 . (2)写反应②的电极反应式: 阳极 , 阴极 . (3)反应③的化学方程式为 . (4)这七种物质中含有共价键的有 .
网址:http://m.1010jiajiao.com/timu3_id_39620[举报]
A、B、C、D、E为中学化学常见的单质或化合物,它们之间的相互转化关系如图所示(部分产物略去).

请回答下列问题:
(1)若A是能使湿润的红色石蕊试纸变蓝的气体,C、D均为空气的主要成分,E是一种有毒气体.
①C分子的电子式为
 :
:
②写出反应I的化学方程式:
③写出反应Ⅱ的化学方程式:
(2)若A是淡黄色固体化合物;常温下D是无色气体;C分子中含有的阴、阳离子均为10电子粒子.
①D的结构式为
②写出反应I的化学方程式:
③写出反应Ⅱ的化学方程式:
(3)将(2)中一定量的气体D通入2L含C的溶液中,在反应后所得的溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发).

①O点溶液中所含溶质的化学式为
②标准状况下,通入气体D的体积为
查看习题详情和答案>>

请回答下列问题:
(1)若A是能使湿润的红色石蕊试纸变蓝的气体,C、D均为空气的主要成分,E是一种有毒气体.
①C分子的电子式为


②写出反应I的化学方程式:
4NH3+5O2
4NO+6H2O
| ||
| △ |
4NH3+5O2
4NO+6H2O
;
| ||
| △ |
③写出反应Ⅱ的化学方程式:
2NO+2CO
N2+2CO2
| ||
2NO+2CO
N2+2CO2
.
| ||
(2)若A是淡黄色固体化合物;常温下D是无色气体;C分子中含有的阴、阳离子均为10电子粒子.
①D的结构式为
O=C=O
O=C=O
,C分子中所含化学键的类型是离子键和共价键
离子键和共价键
;②写出反应I的化学方程式:
2Na2O2+2CO2=2Na2CO3+O2
2Na2O2+2CO2=2Na2CO3+O2
;③写出反应Ⅱ的化学方程式:
Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
(3)将(2)中一定量的气体D通入2L含C的溶液中,在反应后所得的溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发).

①O点溶液中所含溶质的化学式为
NaHCO3、NaOH
NaHCO3、NaOH
,常温下a点溶液的pH>
>
7(填“>”、“=”或“<”),a点溶液中各离子浓度由大到小的关系是c(Na+)>c(Cl-)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-)
c(Na+)>c(Cl-)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-)
;②标准状况下,通入气体D的体积为
44.8
44.8
L,C溶液的物质的量浓度为2.5
2.5
mol?L-1.A、B、C、D是按原子序数由小到大排列的第二、三周期元素的单质.B、E均为组成空气的成分.F的焰色反应呈黄色.在G中,非金属元素与金属元素的原子个数比为1:2.在一定条件下,各物质之间的相互转化关系如图所示(图中部分产物未列出):

请填写下列空白:
(1)A是
(2)H与盐酸反应生成E的化学方程式是:
(3)写出E只与F反应的化学方程式是:
(4)F与G的水溶液恰好反应只生成I和D的离子方程式是:
查看习题详情和答案>>

请填写下列空白:
(1)A是
碳
碳
,C是钠
钠
.(2)H与盐酸反应生成E的化学方程式是:
Na2CO3+2HCl═CO2↑+H2O+2NaCl
Na2CO3+2HCl═CO2↑+H2O+2NaCl
.(3)写出E只与F反应的化学方程式是:
2CO2+2Na2O2═2Na2CO3+O2
2CO2+2Na2O2═2Na2CO3+O2
.(4)F与G的水溶液恰好反应只生成I和D的离子方程式是:
Na2O2+S2-+2H2O═4OH-+S↓+2Na+
Na2O2+S2-+2H2O═4OH-+S↓+2Na+
.A、B、C、X均为中学常见的纯净物,它们之间有如下转化关系(副产物已略去).试回答:

(1)若A是乙醇,则C的结构简式是
A.乙醇汽油是一种新型的化合物
B.汽车使用乙醇汽油能减少有害气体的排放
C.工业常用裂化的方法提高汽油的产量
D.用玉米、高粱发酵可以制得乙醇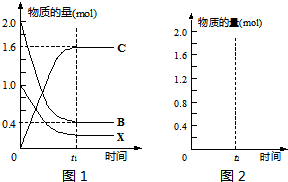
(2)若A是一种工业制硫酸的含金属元素矿物质主要成分,则A的化学式为
①物质B的转化率
②求该温度下反应②的平衡常数
③在上述相同条件下,向相同的容器中投入2mol C,t2时刻达到平衡.请在图2中画出从反应开始至平衡后各物质物质的量与时间的关系图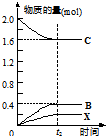
 .
.
查看习题详情和答案>>

(1)若A是乙醇,则C的结构简式是
CH3COOH
CH3COOH
,反应①的化学方程式2CH3CH2OH+O2
2CH3CHO+2H2O
| ||
| △ |
2CH3CH2OH+O2
2CH3CHO+2H2O
;2001年5月,中国宣布将推广“车用乙醇汽油”,所谓乙醇汽油就是在无铅汽油里加入适量乙醇混合而成的一种燃料.下列叙述中一定错误的是
| ||
| △ |
A
A
.A.乙醇汽油是一种新型的化合物
B.汽车使用乙醇汽油能减少有害气体的排放
C.工业常用裂化的方法提高汽油的产量
D.用玉米、高粱发酵可以制得乙醇

(2)若A是一种工业制硫酸的含金属元素矿物质主要成分,则A的化学式为
FeS2
FeS2
,反应②的化学方程式2SO2+O2
2SO3
| 催化剂 |
| △ |
2SO2+O2
2SO3
.某温度T时,在一定条件的2L密闭容器中,反应②从起始到平衡后的关系如图1所示.请据图回答下列问题:| 催化剂 |
| △ |
①物质B的转化率
80%
80%
.②求该温度下反应②的平衡常数
160
160
.③在上述相同条件下,向相同的容器中投入2mol C,t2时刻达到平衡.请在图2中画出从反应开始至平衡后各物质物质的量与时间的关系图


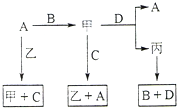 A、B、C、D 是中学化学常见的四种单质,甲、乙、丙为三种化合物,乙在常温下为无色无味的液体,各备物质间转化关系如图:(反应条件已略去),请填空:
A、B、C、D 是中学化学常见的四种单质,甲、乙、丙为三种化合物,乙在常温下为无色无味的液体,各备物质间转化关系如图:(反应条件已略去),请填空: