摘要:在图(1)所示的装置中.烧杯中盛放的是Ba(OH)2溶液.当从滴定管中逐渐加入某种溶液(A)时.溶液的导电性的变化趋势如图(2)所示. 图1 图2 该根据离子反应的特点分析:A溶液中含有的溶质可能是 或 .并写出相应的离子反应的离子方程式:
网址:http://m.1010jiajiao.com/timu3_id_395812[举报]
|
在下图所示的装置中,干燥的烧瓶中充有某种气体,烧杯和滴管内盛放同种溶液.挤压滴管的胶头,即可出现美丽的喷泉.所选试剂与实验事实不相符的是
| |
| [ ] | |
A. |
CO2(NaHCO3溶液)无色喷泉 |
B. |
NH3(H2O含酚酞)红色喷泉 |
C. |
H2S(CuSO4溶液)黑色喷泉 |
D. |
HCl(AgNO3溶液)白色喷泉 |
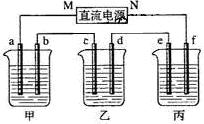
 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.(1)接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题:
①电源的N端为
正
正
极;②电极b上发生的电极反应为
4OH--4e-=O2↑+2H2O
4OH--4e-=O2↑+2H2O
;③电极b上生成的气体在标准状况下的体积:
2.8L
2.8L
;④电极c的质量变化是
16
16
g;⑤电解前后各溶液的pH值的变化(填“不变”、“变大”或“变小”)
甲溶液
变大
变大
,乙溶液减小
减小
,丙溶液不变
不变
;(2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么?
可以,若Cu全部析出,溶液为稀硫酸,电解仍然继续进行
可以,若Cu全部析出,溶液为稀硫酸,电解仍然继续进行
.如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和l00g 10.00%的K2SO4溶液.电极均为石墨电极.

(1)接通电源,经过一段时间后,测得丙中K2SO4浓度为10.37%,乙中c电极质量增加.据此回答问题:
①电源的N端为
②电极b上发生的电极反应为
③电解前后乙溶液 pH
④电极b上生成的气体在标准状况下的体积
(2)写出乙溶液中的电解反应的离子方程式:
查看习题详情和答案>>

(1)接通电源,经过一段时间后,测得丙中K2SO4浓度为10.37%,乙中c电极质量增加.据此回答问题:
①电源的N端为
正
正
极.②电极b上发生的电极反应为
4OH--4e-=2H2O+O2↑
4OH--4e-=2H2O+O2↑
.③电解前后乙溶液 pH
减小
减小
(填“增大”、“减小”或“不变”),丙溶液 pH=不变
不变
.④电极b上生成的气体在标准状况下的体积
2.24L
2.24L
;电极c的质量增加了12.8
12.8
g.(2)写出乙溶液中的电解反应的离子方程式:
2Cu2++2H2O
2Cu+O2↑+4H+
| ||
2Cu2++2H2O
2Cu+O2↑+4H+
.
| ||

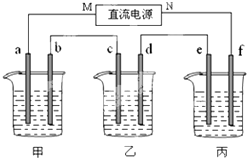 如图所示装置中,甲、乙两个烧杯分别依次盛放200mL饱和食盐水、足量的AgNO3溶液,a、b、c、d四个电极均为石墨电极.接通电源,经过一段时间后,测得乙中d电极质量增加了2.16g.据此回答问题:
如图所示装置中,甲、乙两个烧杯分别依次盛放200mL饱和食盐水、足量的AgNO3溶液,a、b、c、d四个电极均为石墨电极.接通电源,经过一段时间后,测得乙中d电极质量增加了2.16g.据此回答问题: