题目内容
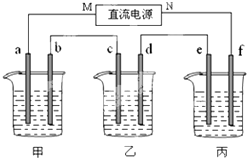 如图所示装置中,甲、乙两个烧杯分别依次盛放200mL饱和食盐水、足量的AgNO3溶液,a、b、c、d四个电极均为石墨电极.接通电源,经过一段时间后,测得乙中d电极质量增加了2.16g.据此回答问题:
如图所示装置中,甲、乙两个烧杯分别依次盛放200mL饱和食盐水、足量的AgNO3溶液,a、b、c、d四个电极均为石墨电极.接通电源,经过一段时间后,测得乙中d电极质量增加了2.16g.据此回答问题:(1)电源的N端为
(2)电极b上发生的电极反应为
(3)电极c上生成的气体在标准状态下的体积:
(4)甲溶液的pH为
(5)欲在丙烧杯中实现铁的表面镀上一层锌,则电解质溶液为
分析:测得乙中d电极质量增加了2.16g,则d电极发生Ag++e-=Ag,所以d电极为阴极,N为电源的负极,乙中阳极为c,发生4OH--4e-=2H2O+O2↑,甲中b为阴极,发生2H++2e?=H2↑,甲电解后生成NaOH,并结合电镀原理及电子守恒计算解答.
解答:解:(1)测得乙中d电极质量增加了2.16g,则d电极发生Ag++e-=Ag,所以d电极为阴极,N为电源的负极,故答案为:负;
(2)电解食盐水,b为阴极,发生2H++2e?=H2↑,故答案为:2H++2e?=H2↑;
(3)d电极发生Ag++e-=Ag,c,发生4OH--4e-=2H2O+O2↑,由电子守恒可知4Ag~O2↑,则气体的体积为
×
×22.4L/mol=0.112L,故答案为:0.112L;
(4)由电子守恒可知2NaOH~2e-~2Ag,n(NaOH)=n(Ag)=0.02mol,则c(NaOH)=
=0.1mol/L,所以pH=13,故答案为:13;
(5)丙烧杯中实现铁的表面镀上一层锌,则电解质溶液为ZnCl2,e为Zn,f电极为阴极,其电极反应式为Zn2++2e-=Zn,故答案为:ZnCl2;Zn;Zn2++2e-=Zn.
(2)电解食盐水,b为阴极,发生2H++2e?=H2↑,故答案为:2H++2e?=H2↑;
(3)d电极发生Ag++e-=Ag,c,发生4OH--4e-=2H2O+O2↑,由电子守恒可知4Ag~O2↑,则气体的体积为
| 2.16g |
| 108g/mol |
| 1 |
| 4 |
(4)由电子守恒可知2NaOH~2e-~2Ag,n(NaOH)=n(Ag)=0.02mol,则c(NaOH)=
| 0.02mol |
| 0.2L |
(5)丙烧杯中实现铁的表面镀上一层锌,则电解质溶液为ZnCl2,e为Zn,f电极为阴极,其电极反应式为Zn2++2e-=Zn,故答案为:ZnCl2;Zn;Zn2++2e-=Zn.
点评:本题考查电解原理,把握乙中d电极质量增加了2.16g判断电极、电源的正负极为解答的关键,明确惰性电极电解时离子的放电顺序及发生的电极反应即可解答,注意转移的电子守恒计算,题目难度不大.

练习册系列答案
相关题目

 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.
