题目内容
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和l00g 10.00%的K2SO4溶液.电极均为石墨电极.

(1)接通电源,经过一段时间后,测得丙中K2SO4浓度为10.37%,乙中c电极质量增加.据此回答问题:
①电源的N端为
②电极b上发生的电极反应为
③电解前后乙溶液 pH
④电极b上生成的气体在标准状况下的体积
(2)写出乙溶液中的电解反应的离子方程式:

(1)接通电源,经过一段时间后,测得丙中K2SO4浓度为10.37%,乙中c电极质量增加.据此回答问题:
①电源的N端为
正
正
极.②电极b上发生的电极反应为
4OH--4e-=2H2O+O2↑
4OH--4e-=2H2O+O2↑
.③电解前后乙溶液 pH
减小
减小
(填“增大”、“减小”或“不变”),丙溶液 pH=不变
不变
.④电极b上生成的气体在标准状况下的体积
2.24L
2.24L
;电极c的质量增加了12.8
12.8
g.(2)写出乙溶液中的电解反应的离子方程式:
2Cu2++2H2O
2Cu+O2↑+4H+
| ||
2Cu2++2H2O
2Cu+O2↑+4H+
.
| ||
分析:(1)①该装置是电解池,接通电源,经过一段时间后,乙中c电极质量增加,说明C电极是电解池阴极,则d电极是阳极,连接电解池阳极的原电池电极是正极.
②电解氢氧化钠溶液时,阳极上氢氧根离子放电生成氧气.
③电解硫酸铜溶液时,阴极上析出铜,阳极上析出氧气,根据溶液中氢氧根离子浓度的变化判断pH值的变化;电解丙溶液时,根据阴阳极上析出的物质确定溶液中氢离子浓度是否变化来判断溶液的pH值是否变化.
④根据丙溶液中水减少的质量结合转移电子数相等计算电极b上生成的气体体积和电极c的质量增加.
(2)电解硫酸铜溶液时阴极上析出铜,阳极上析出氧气.
②电解氢氧化钠溶液时,阳极上氢氧根离子放电生成氧气.
③电解硫酸铜溶液时,阴极上析出铜,阳极上析出氧气,根据溶液中氢氧根离子浓度的变化判断pH值的变化;电解丙溶液时,根据阴阳极上析出的物质确定溶液中氢离子浓度是否变化来判断溶液的pH值是否变化.
④根据丙溶液中水减少的质量结合转移电子数相等计算电极b上生成的气体体积和电极c的质量增加.
(2)电解硫酸铜溶液时阴极上析出铜,阳极上析出氧气.
解答:解:(1)①该装置是电解池,接通电源,经过一段时间后,乙中c电极质量增加,说明C电极是电解池阴极,则d电极是阳极,连接电解池阳极的原电池电极是正极,所以N是原电池正极.
故答案为:正极.
②电解氢氧化钠溶液时,阳极上氢氧根离子放电生成氧气,电极反应式为:4OH--4e-=2H2O+O2↑.
故答案为:4OH--4e-=2H2O+O2↑.
③电解硫酸铜溶液时,阴极上析出铜,阳极上析出氧气,导致溶液中氢离子浓度大于氢氧根离子浓度,溶液呈酸性,所以溶液的pH值变小;电解硫酸钠溶液时,阴极上析出氢气,阳极上析出氧气,实际上电解的是水,硫酸钠溶液的浓度增大,但溶液的pH值不变.
故答案为:减小;不变.
④l00g 10.00%的K2SO4溶液电解一段时间后K2SO4浓度变为
,电解硫酸钾溶液实际上是电解的水,所以电解水的质量为100-
=3.6g,减少3.6g水转移电子的物质的量=
×2=0.4mol;当转移0.4mol电子时,b上生成的气体体积=
×22.4L/mol=2.24L;电极c增加的质量=
×64g/mol=12.8g.
故答案为:2.24L;12.8g.
(2)电解硫酸铜溶液时阴极上析出铜,阳极上析出氧气,2Cu2++2H2O
2Cu+O2↑+4H+
故答案为:2Cu2++2H2O
2Cu+O2↑+4H+
故答案为:正极.
②电解氢氧化钠溶液时,阳极上氢氧根离子放电生成氧气,电极反应式为:4OH--4e-=2H2O+O2↑.
故答案为:4OH--4e-=2H2O+O2↑.
③电解硫酸铜溶液时,阴极上析出铜,阳极上析出氧气,导致溶液中氢离子浓度大于氢氧根离子浓度,溶液呈酸性,所以溶液的pH值变小;电解硫酸钠溶液时,阴极上析出氢气,阳极上析出氧气,实际上电解的是水,硫酸钠溶液的浓度增大,但溶液的pH值不变.
故答案为:减小;不变.
④l00g 10.00%的K2SO4溶液电解一段时间后K2SO4浓度变为
| l00g ×10.00% |
| 10.37% |
| l00g ×10.00% |
| 10.37% |
| 3.6g |
| 18g/mol |
| 0.4mol |
| 4 |
| 0.4mol |
| 2 |
故答案为:2.24L;12.8g.
(2)电解硫酸铜溶液时阴极上析出铜,阳极上析出氧气,2Cu2++2H2O
| ||
故答案为:2Cu2++2H2O
| ||
点评:本题考查了原电池原理以及物质的量的有关计算,根据转移电子数相等来分析解答即可,难度不大.

练习册系列答案
相关题目

 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.
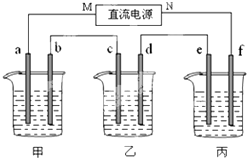 如图所示装置中,甲、乙两个烧杯分别依次盛放200mL饱和食盐水、足量的AgNO3溶液,a、b、c、d四个电极均为石墨电极.接通电源,经过一段时间后,测得乙中d电极质量增加了2.16g.据此回答问题:
如图所示装置中,甲、乙两个烧杯分别依次盛放200mL饱和食盐水、足量的AgNO3溶液,a、b、c、d四个电极均为石墨电极.接通电源,经过一段时间后,测得乙中d电极质量增加了2.16g.据此回答问题: