网址:http://m.1010jiajiao.com/timu3_id_395810[举报]
(1)工业上可用氯化钠为原料,通过电解的方法制得NaClO,工业上制取NaClO的离子反应方程式为______ 电解后的溶液PH______ 7(填大于、小于、等于);其原因是______ (用离子方程式表示)
(2)KAl(SO4)2溶液中质子守恒等式为______
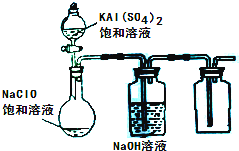
(3)某小组同学用下图所示装置探究饱和NaClO和KAl(SO4)2溶液混合反应的实验.
①打开活塞向烧瓶中加入饱和KAl(SO4)2溶液,产生大量的白色胶状沉淀.此时反应的离子方程式为______.②将烧瓶中的混合液在阳光照射下,不久烧瓶中有黄绿色气体产生,充分反应后集气瓶中收集到一种无色无味的气体.写出在光照射下混合液中反应的化学方程式是______.
(4)若将分液漏斗中的KAl(SO4)2溶液换成硫酸亚铁铵(一种复盐:(NH4)2SO4?FeSO4)溶液,其他不变.打开分液漏斗活塞向烧瓶中滴入足量的硫酸亚铁铵溶液.观察到烧瓶中有红褐色沉淀产生,但是没有观察到黄绿色气体产生.此时烧瓶中发生的氧化还原反应的离子方程式为______.
(5)取100mL 0.1mol/L Ba(OH)2溶液,向其中逐滴加入同浓度的KHSO4溶液至Ba2+恰好完全沉淀,此时溶液的PH值为______ (忽略两溶液混合时的体积变化,混合后溶液的温度为100℃,100℃时Kw=1x10-12)
(1)工业上可用氯化钠为原料,通过电解的方法制得NaClO,工业上制取NaClO的离子反应方程式为 电解后的溶液PH 7(填大于、小于、等于);其原因是 (用离子方程式表示)
(2)KAl(SO4)2溶液中质子守恒等式为
(3)某小组同学用下图所示装置探究饱和NaClO和KAl(SO4)2溶液混合反应的实验.
①打开活塞向烧瓶中加入饱和KAl(SO4)2溶液,产生大量的白色胶状沉淀.此时反应的离子方程式为 .②将烧瓶中的混合液在阳光照射下,不久烧瓶中有黄绿色气体产生,充分反应后集气瓶中收集到一种无色无味的气体.写出在光照射下混合液中反应的化学方程式是 .
(4)若将分液漏斗中的KAl(SO4)2溶液换成硫酸亚铁铵(一种复盐:(NH4)2SO4?FeSO4)溶液,其他不变.打开分液漏斗活塞向烧瓶中滴入足量的硫酸亚铁铵溶液.观察到烧瓶中有红褐色沉淀产生,但是没有观察到黄绿色气体产生.此时烧瓶中发生的氧化还原反应的离子方程式为 .
(5)取100mL 0.1mol/L Ba(OH)2溶液,向其中逐滴加入同浓度的KHSO4溶液至Ba2+恰好完全沉淀,此时溶液的PH值为 (忽略两溶液混合时的体积变化,混合后溶液的温度为100℃,100℃时Kw=1x10-12)
 查看习题详情和答案>>
查看习题详情和答案>>
 (2013?达州模拟)NaClO和KAl(SO4)2都是重要的化工产品,均可应用于造纸业.
(2013?达州模拟)NaClO和KAl(SO4)2都是重要的化工产品,均可应用于造纸业.(1)工业上可用氯化钠为原料,通过电解的方法制得NaClO,工业上制取NaClO的离子反应方程式为
| ||
| ||
(2)KAl(SO4)2溶液中质子守恒等式为
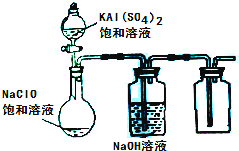
(3)某小组同学用下图所示装置探究饱和NaClO和KAl(SO4)2溶液混合反应的实验.
①打开活塞向烧瓶中加入饱和KAl(SO4)2溶液,产生大量的白色胶状沉淀.此时反应的离子方程式为
| ||
| ||
(4)若将分液漏斗中的KAl(SO4)2溶液换成硫酸亚铁铵(一种复盐:(NH4)2SO4?FeSO4)溶液,其他不变.打开分液漏斗活塞向烧瓶中滴入足量的硫酸亚铁铵溶液.观察到烧瓶中有红褐色沉淀产生,但是没有观察到黄绿色气体产生.此时烧瓶中发生的氧化还原反应的离子方程式为
(5)取100mL 0.1mol/L Ba(OH)2溶液,向其中逐滴加入同浓度的KHSO4溶液至Ba2+恰好完全沉淀,此时溶液的PH值为
(1)则A的化学式为 。
(2)取B的水溶液2mL与新制Cu(OH)2混合加热,发现能出现砖红色沉淀。 则物质B为 。
(3)取16.8gC固体加强热,将生成的气体依次通过经称量过的装CaCl2固体的干燥管和装足量Ba(OH)2水溶液的洗气瓶,后经再次称量发现干燥管增重1.8g,洗气瓶增重4.4g。写出C物质加入水后的或电离方程式或离子方程式并说明水溶液显碱性的原因 。
(4)D 是一种含氮质量分数为87.5% 的液态化合物,相对分子质量与空气中某种主要成分的相对分子质量相同,则该物质的结构简式为:___________________;D为一种二元弱碱,则D与过量硫酸反应的产物是____________________ (用化学式表示),D与一种黑色氧化物反应的产物中有一种气态单质及(2)中出现的砖红色物质。写出其化学方程式:__________________________________。
(12分)Na2CO3俗称纯碱、苏打,NaHCO3俗称小苏打,两者在日常生活和工业生产中都有着广泛的应用。某化学兴趣小组设计了如下实验来探究两者的某些性质。请你根据所学知识帮他们完成有关的设计和实验。
(1)甲同学测定两者的酸碱性:各取一定量的固体溶于水,配成相同浓度的溶液,测定其pH值,测定结果为Na2CO3、NaHCO3的pH分别为a和b(a、b均大于7)。
Ⅰ.测定溶液的pH值所用的主要仪器有:pH试纸、表面皿、 和标准比色卡。
Ⅱ.有关①100mL0.1mol·L-1NaHCO3、②100mL0.1 mol·L-1Na2CO3两种溶液的叙述不正确的是( )
A.溶液中水电离出的OH-个数:②>① B.溶液中阴离子的物质的量浓度之和:②>①
C.①溶液中:c(CO32-)>c(H2CO3) D.②溶液中:c(HCO3-)>c(H2CO3)
(2)乙同学取一定量的碳酸钠溶液于试管中,滴加2~3滴酚酞试液,发现溶液变红,继续滴加BaCl2溶液,预计可观察到 ,请你结合必要的离子方程式,应用平衡的观点解释有关现象的产生: 。
(3)常温下,现有pH均为11的标签模糊的NaOH和Na2CO3溶液,则NaOH溶液中由水电离出来的OH-浓度为Na2CO3溶液中水电离出来OH-浓度的 倍。丙同学设计如下实验予以区别:各取1mL两种溶液加水稀释至1L,分别测定其pH。请问丙同学是如何判断哪瓶溶液为Na2CO3溶液? ;丁同学各取1mL两种溶液,分别滴加少量AlCl3溶液观察有无沉淀或气体进行鉴别,则溶液滴加后同时产生沉淀和气体的反应离子方程式为 。
(4)已知:Ksp(CaCO3)=4.96×10-9,不考虑其它因素影响,现将0.400 mol·L-1的Na2CO3溶液和0.200 mol·L-1的CaCl2溶液等体积混合,则混合后溶液中Ca2+浓度为 mol·L-1。
查看习题详情和答案>>