网址:http://m.1010jiajiao.com/timu3_id_3950039[举报]
铜是人类最早生产和使用的金属之一,在化学反应中铜元素可表现为0、+1、+2价。
Ⅰ.(1)在西汉古籍中曾有记载:“曾青得铁则化为铜”,即:曾青(CuSO4)跟铁反应生成铜,试写出该反应的离子方程式 。
(2)在原电池和电解池中,铜常用作电极,下列有关说法正确的是
| A.锌铜原电池中铜是正极 | B.用电解法精炼铜时粗铜作阴极 |
| C.在镀件上镀铜时铜与电源正极相连 | D.铜作阳极时不一定溶解 |
【提出问题】碳酸钙受热分解生成CaO和CO2,那么无水硫酸铜受热分解也只生成CuO和SO3吗?
【设计实验】按如图装置进行试验。
|
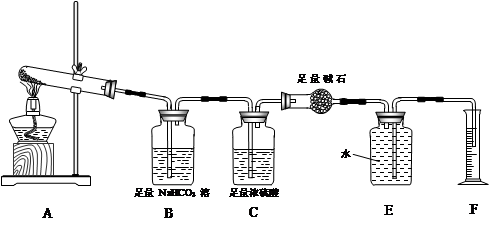 【实验过程】
【实验过程】a.准确称取无水硫酸铜2.40g于装置A试管中加热,直至固体全部变为黑色,经验证该黑色粉末为CuO。
b.实验中,观察到装置E中的水部分被排入量筒中;实验结束后,测得量筒中水的体积为112mL(已折算成标准状态下气体的体积),并测得干燥管D的质量增加了1.32g。
(3)装置C的作用 。
(4)根据装置E、F中现象,推测还有气体 (填分子式)生成;实验生成的SO3为 mol。(5)装置A中反应的化学方程式为 。
【实验结论】无水硫酸铜受热分解不仅仅生成CuO和SO3。
【反思与评价】
(6)任何实验都存在误差,请指出本实验中可能造成误差的因素是 (任写2点)。 查看习题详情和答案>>
(1)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=_1275.6kJ?mol-1
②2CO(g)+O2(g)=2CO2(g)△H=_556.0kJ?mol-1
③H2O(l)=H2O(g)△H=+44.0kJ?mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式______
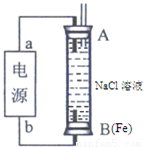
(2)某同学利用甲醇燃料电池为电源,设计了一种电解法制取Fe(OH)2的实验装置(如图),通电后,溶液中产生大量的白色沉淀,且较长时间不变色.则电源中a极为______极(填“正”或“负”),其电极反应式为______.装置上端A极电极材料是______(填化学式),B电极上的电极反应式为______.
(3)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
②实验1中,以v(H2)表示的平均反应速率为______.
③900℃时,按CO(g)、H2O(g)、CO2(g) 和 H2(g)的物质的量分别是0.8mol、1.0mol、0.6mol和0.8mol分别加入该容器,则此时反应的v(正)______v(逆)(填“>”“<”或“=”中之一).
④实验3跟实验2相比,改变的条件可能是______.
 查看习题详情和答案>>
查看习题详情和答案>>
目前工业上有一种用CO2来生产燃料甲醇的方法,可以将CO2变废为宝。
(1)已知在常温常压下:
①2CH3OH(l)+3O2(g)= 2CO2(g)+4H2O(g) △H= _1275.6 kJ·mol-1
②2CO(g)+ O2(g)= 2CO2(g) △H= _556.0 kJ·mol-1
③H2O(l) = H2O(g) △H=+ 44.0 kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式 。
(2)某同学利用甲醇燃料电池为电源,设计了一种电解法制取Fe(OH)2的实验装置(如图),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。则电源中a极为 极(填“正”或“负”),其电极反应式为 。装置上端A极电极材料是 (填化学式),B电极上的电极反应式为 。

(3)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:CO(g) +H2O(g) CO2(g) + H2(g),得到如下三组数据:
CO2(g) + H2(g),得到如下三组数据:
|
实验组 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
|
|
H2O |
CO |
CO2 |
|||
|
1 |
650 |
2 |
4 |
1.6 |
5 |
|
2 |
900 |
1 |
2 |
0.4 |
3 |
|
3 |
900 |
1 |
2 |
0.4 |
1 |
①该反应的正反应为 (填“吸”或“放”)热反应。
②实验1中,以v(H2)表示的平均反应速率为 。
③900℃时,按CO(g)、H2O(g)、CO2(g) 和 H2(g)的物质的量分别是0.8mol、1.0mol、0.6 mol和0.8 mol分别加入该容器,则此时反应的v(正) v(逆)(填“>”“<”或“=”中之一)。
④实验3跟实验2相比,改变的条件可能是 。
查看习题详情和答案>>
(1)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=_1275.6kJ?mol-1
②2CO(g)+O2(g)=2CO2(g)△H=_556.0kJ?mol-1
③H2O(l)=H2O(g)△H=+44.0kJ?mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式______
(2)某同学利用甲醇燃料电池为电源,设计了一种电解法制取Fe(OH)2的实验装置(如图),通电后,溶液中产生大量的白色沉淀,且较长时间不变色.则电源中a极为______极(填“正”或“负”),其电极反应式为______.装置上端A极电极材料是______(填化学式),B电极上的电极反应式为______.
(3)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
②实验1中,以v(H2)表示的平均反应速率为______.
③900℃时,按CO(g)、H2O(g)、CO2(g) 和 H2(g)的物质的量分别是0.8mol、1.0mol、0.6mol和0.8mol分别加入该容器,则此时反应的v(正)______v(逆)(填“>”“<”或“=”中之一).
④实验3跟实验2相比,改变的条件可能是______.

 (2013?济南一模)目前工业上有一种用CO2来生产燃料甲醇的方法,可以将CO2变废为宝.
(2013?济南一模)目前工业上有一种用CO2来生产燃料甲醇的方法,可以将CO2变废为宝.(1)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=_1275.6kJ?mol-1
②2CO(g)+O2(g)=2CO2(g)△H=_556.0kJ?mol-1
③H2O(l)=H2O(g)△H=+44.0kJ?mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式
(2)某同学利用甲醇燃料电池为电源,设计了一种电解法制取Fe(OH)2的实验装置(如图),通电后,溶液中产生大量的白色沉淀,且较长时间不变色.则电源中a极为
(3)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
②实验1中,以v(H2)表示的平均反应速率为
③900℃时,按CO(g)、H2O(g)、CO2(g) 和 H2(g)的物质的量分别是0.8mol、1.0mol、0.6mol和0.8mol分别加入该容器,则此时反应的v(正)
④实验3跟实验2相比,改变的条件可能是