��Ŀ����
Ŀǰ��ҵ����һ����CO2������ȼ�ϼ״��ķ��������Խ�CO2���Ϊ����
��1����֪�ڳ��³�ѹ�£�
��2CH3OH(l)+3O2(g)= 2CO2(g)+4H2O(g) ��H= _1275.6 kJ��mol-1
��2CO(g)+ O2(g)= 2CO2(g) ��H= _556.0 kJ��mol-1
��H2O(l) = H2O(g) ��H=+ 44.0 kJ��mol-1
д���״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽ ��
��2��ijͬѧ���ü״�ȼ�ϵ��Ϊ��Դ�������һ�ֵ�ⷨ��ȡFe(OH)2��ʵ��װ�ã���ͼ����ͨ�����Һ�в��������İ�ɫ�������ҽϳ�ʱ�䲻��ɫ�����Դ��a��Ϊ �������������������缫��ӦʽΪ ��װ���϶�A���缫������ ���ѧʽ����B�缫�ϵĵ缫��ӦʽΪ ��

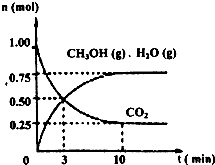
��3������ͬ����CO(g)��H2O(g)�ֱ�ͨ�����Ϊ2L�ĺ����ܱ������У����з�Ӧ��CO(g) +H2O(g) CO2(g) + H2(g)���õ������������ݣ�
CO2(g) + H2(g)���õ������������ݣ�
|
ʵ���� |
�¶�/�� |
��ʼ��/mol |
ƽ����/mol |
�ﵽƽ������ʱ��/min |
|
|
H2O |
CO |
CO2 |
|||
|
1 |
650 |
2 |
4 |
1.6 |
5 |
|
2 |
900 |
1 |
2 |
0.4 |
3 |
|
3 |
900 |
1 |
2 |
0.4 |
1 |
�ٸ÷�Ӧ������ӦΪ ��������š����ȷ�Ӧ��
��ʵ��1�У���v(H2)��ʾ��ƽ����Ӧ����Ϊ ��
��900��ʱ����CO(g)��H2O(g)��CO2(g) �� H2(g)�����ʵ����ֱ���0.8mol��1.0mol��0.6 mol��0.8 mol�ֱ��������������ʱ��Ӧ��v(��) v(��)�������������������֮һ����
��ʵ��3��ʵ��2��ȣ��ı������������ ��
��1��CH3OH(l)+ O2(g)= CO (g)+2H2O(l) ��H= _447.8 kJ��mol-1(2��)��
��2����(1��)��O2+4e-+2H2O=4OH-(2��)��Fe(1��)��2H++2 e-=H2����2H2O+2e-=H2+2OH-��(2��)��
��3���� �� (2��) ��0.16mol/(L��min) (2��) �ۣ�(2��) ��ʹ���˴������Ӵ���ѹǿ (�δ�һ�֣�2��)��
��������
���������
��1������������Ȼ�ѧ����ʽ���ɽ�����-�ڣ�/2+�ۿɵó���CH3OH(l)+ O2(g)= CO (g)+2H2O(l) ��H= _447.8 kJ��mol-1��
��2������װ��ͼ�����ɵ������������ϳ�ʱ�䲻��ɫ��֪��AB������һ�����ɵ��������Ӷ�����������������������ǿ�����ԣ�����һ��������������A��Ϊ�������缫����Ϊ�����ŵ������������ӣ�B��Ϊ�������缫����Ϊ�����缫��ӦʽΪ��2H++2 e-=H2����2H2O+2e-=H2+2OH-�����״�ȼ�ϵ���У�a��Ϊ�����������ĵ缫��ӦΪ��O2+4e-+2H2O=4OH-��
��3������1��2����ʵ�����ݣ�1����k=2.67��2����k=0.17���ʴ����¶ȵ�����kֵ��С��˵����Ӧ������ȣ�1���дﵽƽ��ʱ��c��H2��=0.8mol/L����Ӧʱ��Ϊ5min���ʷ�Ӧ����Ϊ��v(H2)=0.16mol/(L��min)������900��ʱ����CO(g)��H2O(g)��CO2(g) �� H2(g)�����ʵ����ֱ���0.8mol��1.0mol��0.6 mol��0.8 mol�ֱ�������������Qc=0.6�����ڴ��¶��µ�kֵ����ʱ��Ӧ�������ƶ�����v(��)��v(��) ���ٶԱ�2��3��ʵ�����ݣ���֪��Ӧû�з����ƶ���ֻ�Ƿ�Ӧ���ʼӿ죬�ʴ˿�����ʹ���˴�����Ӵ���ѹǿ��
���㣺�����˸�˹���ɡ��绯ѧ�ͻ�ѧƽ��֪ʶ��

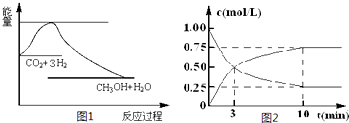
 2009��12��7��һ18���ڵ������籾�����ٿ������Ϲ�������飬��δ��Ӧ������仯��ȫ���ж�ǩ���µ�Э�飮����ν��ʹ�����CO2�ĺ�������Ч�ؿ�������CO2��������ȫ������ձ����ӣ�Ϊ��С������CO2�Ի�����Ӱ�죬һ����������������������ŷ�������һ�����ѧ�Ҽ�ǿ�˶�CO2�������õ��о���
2009��12��7��һ18���ڵ������籾�����ٿ������Ϲ�������飬��δ��Ӧ������仯��ȫ���ж�ǩ���µ�Э�飮����ν��ʹ�����CO2�ĺ�������Ч�ؿ�������CO2��������ȫ������ձ����ӣ�Ϊ��С������CO2�Ի�����Ӱ�죬һ����������������������ŷ�������һ�����ѧ�Ҽ�ǿ�˶�CO2�������õ��о���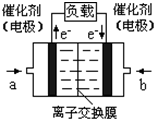 ��ͼ����a��ͨ�����
��ͼ����a��ͨ�����

 CH3OH��g��+H2O��g��
CH3OH��g��+H2O��g��