题目内容
铜是人类最早生产和使用的金属之一,在化学反应中铜元素可表现为0、+1、+2价。
Ⅰ.(1)在西汉古籍中曾有记载:“曾青得铁则化为铜”,即:曾青(CuSO4)跟铁反应生成铜,试写出该反应的离子方程式 。
(2)在原电池和电解池中,铜常用作电极,下列有关说法正确的是
| A.锌铜原电池中铜是正极 | B.用电解法精炼铜时粗铜作阴极 |
| C.在镀件上镀铜时铜与电源正极相连 | D.铜作阳极时不一定溶解 |
【提出问题】碳酸钙受热分解生成CaO和CO2,那么无水硫酸铜受热分解也只生成CuO和SO3吗?
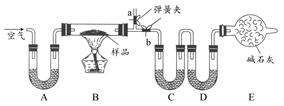
【设计实验】按如图装置进行试验。
|
 【实验过程】
【实验过程】a.准确称取无水硫酸铜2.40g于装置A试管中加热,直至固体全部变为黑色,经验证该黑色粉末为CuO。
b.实验中,观察到装置E中的水部分被排入量筒中;实验结束后,测得量筒中水的体积为112mL(已折算成标准状态下气体的体积),并测得干燥管D的质量增加了1.32g。
(3)装置C的作用 。
(4)根据装置E、F中现象,推测还有气体 (填分子式)生成;实验生成的SO3为 mol。(5)装置A中反应的化学方程式为 。
【实验结论】无水硫酸铜受热分解不仅仅生成CuO和SO3。
【反思与评价】
(6)任何实验都存在误差,请指出本实验中可能造成误差的因素是 (任写2点)。
Ⅰ(1)Fe+Cu2+== Fe2++Cu (2分)
(2)AC (各1分,共2分,选错不得分)
Ⅱ(3)干燥气体(或吸收混合气体中水蒸气)(2分)
(4)O2(2分) 0.00500(2分)
(5)3CuSO4 3CuO+2SO2↑+SO3↑+O2↑(2分)
3CuO+2SO2↑+SO3↑+O2↑(2分)
(6)①装置内部有气体滞留,气体吸收不完全;②称量造成的误差;③读数造成的误差;④导管中有水残留导致气体体积误差。(2分,答案合理均可给分)
解析试题分析:Ⅰ(1)铁与硫酸铜发生置换反应,离子方程式为Fe+Cu2+== Fe2++Cu
(2)A、锌铜原电池中锌比铜活泼,作负极,铜是正极,正确;B、用电解法精炼铜时粗铜作阳极,发生氧化反应,阴极有纯铜析出,错误;C、镀铜时铜与电源正极相连,作阳极,发生氧化反应,阴极上有铜析出,达到镀铜目的,正确;D、铜作阳极时一定溶解,错误,答案选AC;
Ⅱ(3)D装置是吸收混合气体,所以C装置是干燥混合气体,防止水进入D中;
(4)根据硫酸铜的元素组成,及该气体不溶于水判断还有O2生成;其物质的量是0.112L/22.4L/mol=0.005mol,所以硫酸铜分解的产物有氧化铜、二氧化硫、三氧化硫、氧气,其化学方程式为3CuSO4 3CuO+2SO2↑+SO3↑+O2↑,由此可知,生成SO3为0.005mol;
3CuO+2SO2↑+SO3↑+O2↑,由此可知,生成SO3为0.005mol;
(5)根据(4)可知装置A中反应的化学方程式为3CuSO4 3CuO+2SO2↑+SO3↑+O2↑
3CuO+2SO2↑+SO3↑+O2↑
(6)本实验中可能造成误差的因素是①装置内部有气体滞留,气体吸收不完全;②称量造成的误差;③读数造成的误差;④导管中有水残留导致气体体积误差。
考点:考查铁、铜的置换反应,电化学反应原理的应用,反应产物的判断,化学方程式的书写,误差分析

 高效智能课时作业系列答案
高效智能课时作业系列答案(18分)实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数w(Na2CO3),称取此混合物5.0g,溶于水中,配成250mL溶液。
方案一:沉淀法。利用化学反应把HCO3-、CO32-完全转化为沉淀,称量干燥沉淀的质量,由此计算混合物中w (Na2CO3)。
(1)量取100 mL配制好的溶液于烧杯中,滴加足量沉淀剂,把溶液中HCO3-、CO32-完全转化为沉淀,应选用的试剂是___________ (填编号)。
| A.CaCl2溶液 | B.MgSO4溶液 | C.NaCl溶液 | D.Ba(OH)2溶液 |
(3) 过滤,提取沉淀,则过滤操作所需要的玻璃仪器除烧杯外,还有________________________。
(4) 将沉淀洗涤,并充分干燥,称量沉淀的质量为mg,由此可以计算w(Na2CO3)。如果此步中,沉淀未干燥充分就称量,则测得w (Na2CO3)________________(填偏大或偏小、无影响)。
方案二:量气法。量取10.00mL配制好的溶液与足量稀硫酸溶液反应,测定生成气体在通常状况(约20℃,1.01×105Pa)的体积,由此计算混合物中w (Na2CO3)。
(1)装置中导管a的作用是 。
(2)反应结束后,为了准确地测量气体体积,量气管在读数时应注意:
①_______________________________,
②_________________________________,
③眼睛视线与液面最低处相平。
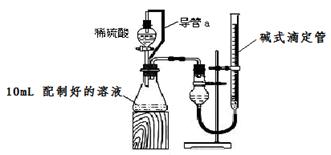
(3)实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL。则 产生CO2的体积为 mL。
方案三:滴定法。量取25.00 mL配制好的溶液加入锥形瓶中,滴加2滴酚酞试剂,摇匀,用0.2000 mol/L盐酸进行滴定到终点(已知终点时反应H++CO32- =HCO3-恰好完全)。重复此操作2次,消耗盐酸的体积平均值为20.00 mL。
(1)量取25.00 mL配制好的溶液,应选择_______________仪器来完成。
(2)判断滴定终点的依据是_____________________。
(3)此法测得w(Na2CO3)= %。
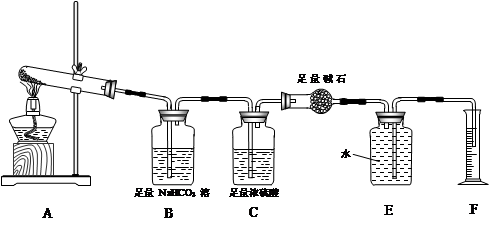
某研究性学习小组在网上收集到信息:钠、镁等活泼金属都能在CO2气体中燃烧。他们对钠在CO2气体中燃烧后得到的白色产物进行了如下探究:
【实验操作】将燃烧的钠迅速伸入装满CO2的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底有黑色颗粒,瓶壁上附着白色物质。
【提出假设】
假设1:白色物质是Na2O。
假设2:白色物质是Na2CO3。
假设3:白色物质是Na2O和Na2CO3的混合物。
【设计方案】该小组对燃烧后生成的白色物质进行如下探究:
| 实验方案 | 实验操作 | 实验现象 | 结论 |
| 方案1 | 取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 | 溶液变成红色 | 白色物质为Na2O |
| 方案2 | ①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液。②静置片刻,取上层清液于试管中,滴加无色酚酞试液 | ①出现白色沉淀 ②无明显现象 | 白色物质为Na2CO3 |
回答下列问题:
(1)写出金属镁与二氧化碳反应的化学方程式: 。
(2)甲同学认为方案1得到的结论不正确,其理由是 。
(3)乙同学认为方案2得到的结论正确,白色物质为 。
(4)钠在二氧化碳中燃烧的化学反应方程式为 。
(5)丙同学认为白色物质有可能是氢氧化钠。你是否同意丙同学的观点,并简述理由: 。
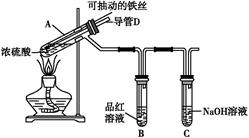
在呼吸面具和潜水艇中可用Na2O2作为供氧剂,请选择适当的化学试剂和实验用品,用下图中的实验装置进行试验,证明Na2O2可作供氧剂。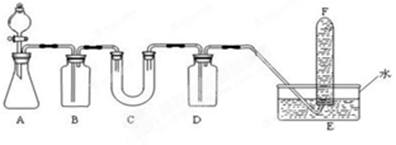
(1)A是制取CO2的装置。在实验室里,CO2常用稀盐酸与石灰石反应来制取,反应的化学方程式为: 。(2分)
(2)填写表中空格:
| 仪器 | 加入试剂 | 加入该试剂的目的 |
| B | 饱和NaHCO3溶液 | (2分) |
| C | Na2O2 | (2分) |
| D | NaOH溶液 | (2分) |
(3)Na2O2与CO2反应的化学方程式: 。(2分)
(4)试管F中收集满气体后,下一步验操作是: 。(2分)