摘要:67].500K时气相反应:H2O十O→2OH的△H=72kJ.Es=77kJ·mol-1.估算两个羟基反应生成H2O和O的Es值为多少?
网址:http://m.1010jiajiao.com/timu3_id_394944[举报]
小明为研究添加食品中的食盐中的碘酸钾的稳定性,查阅文献得到相关信息如下,回答下列问题
(1)相同温度下,PH=
(2)PH=7时,随着温度的升高碘酸钾的稳定性
(3)小明猜想,碘酸钾因转化为碘单质.请设计一个实验方案证明是否有碘单质生成:
(4)写出一条使用的加碘食盐的合理化建议:
查看习题详情和答案>>
| 编号 | 碘酸钾浓度/mol/L | PH | 碘酸钾损失率/% | |||
| 30℃ | 50℃ | 80℃ | 100℃ | |||
| 1 | 0.003 | 0 | 21 | 70.3 | 71 | 77.3 |
| 2 | 0.003 | 7 | 0 | 0.3 | 0.67 | 1 |
| 3 | 0.003 | 14 | 1.3 | 2.7 | 1.3 | 1 |
0
0
时,碘酸钾最不稳定.(2)PH=7时,随着温度的升高碘酸钾的稳定性
减弱
减弱
(填“增强”,“不变”或“减弱”);(3)小明猜想,碘酸钾因转化为碘单质.请设计一个实验方案证明是否有碘单质生成:
用湿润的淀粉碘化钾试纸检验,如果试纸变蓝色就证明含有碘单质
用湿润的淀粉碘化钾试纸检验,如果试纸变蓝色就证明含有碘单质
;(4)写出一条使用的加碘食盐的合理化建议:
炒好菜再放盐
炒好菜再放盐
.将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
(1)实验1中,从反应开始到平衡,以H2的浓度变化表示的平均反应速率为
(2)该反应的正反应为
(3)计算650℃时该反应的平衡常数K(650℃)=
常数K(900℃)
(4)实验3跟实验2相比,改变的条件可能是
(5)下列事实能说明该反应达到平衡的有
①容器内压强不再改变 ②容器内气体密度不再改变
③容器内H2O的质量不再改变 ④v正(H2)=v逆(CO)
⑤反应热不再改变.
查看习题详情和答案>>
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
0.16mol/(L?min)
0.16mol/(L?min)
.(2)该反应的正反应为
放
放
(填“吸”或“放”)热反应.(3)计算650℃时该反应的平衡常数K(650℃)=
2.67
2.67
;估计900℃时该反应的平衡常数K(900℃)
<
<
(填“>”、“<”或“=”)K(650℃).(4)实验3跟实验2相比,改变的条件可能是
使用了催化剂或增大了压强
使用了催化剂或增大了压强
.(5)下列事实能说明该反应达到平衡的有
③④
③④
(填序号).①容器内压强不再改变 ②容器内气体密度不再改变
③容器内H2O的质量不再改变 ④v正(H2)=v逆(CO)
⑤反应热不再改变.
I.设反应①Fe(s)+CO2(g)?FeO(s)+CO(g)的平衡常数为K1.反应 ②Fe(s)+H2O(g)?FeO(s)+H2(g)的平衡常数为K2,在不同温度下,K1、K2的值如下:
(1)现有反应③CO2(g)+H2(g)?CO(g)+H2O(g),这是一个 (填“吸”或“放”)热反应,要使平衡③向右移动,可采取的措施有 (填序号).
A.缩小反应容器容积 B.扩大反应容器容积 C.降低温度
D.升高温度 E.使用合适的催化剂 F.设法减少CO的量
(2)若反应Fe(s)+CO2(g)?FeO(s)+CO(g)在温度T1下进行;Fe(s)+H2O(g)?FeO(s)+H2(g)在温度T2下进行,已知T1>T2,且c(CO2)>c(H2O)(其他条件均相同),则两者的反应速率 (填序号).
A.前者大 B.后者大 C.一样大 D.无法判断
II.(1)钢铁的表面发蓝、发黑处理是常用的防腐方法.请配平主要反应的方程式:
Na2FeO2+ NaNO2+ H2O═ NaFeO2+ NH3↑+ NaOH
(2)钢铁经冷、浓HNO3处理后“钝化”能达到防腐目的,不同浓度的HNO3与铁反应的还原产物很复杂,其分布曲线如下图.
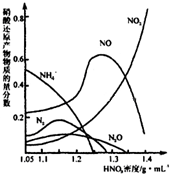
①图示可知,分析HNO3与铁反应的规律是 .
②工业上一般不用冷浓硝酸进行铁表面处理,其可能的原因是 .
(3)金属(M)的腐蚀是因为发生反应:M-ne-→Mn+,除了上述表面处理的方法外,下列方法也能起到防腐作用的是 (填字母编号)
A.在铁中掺入铬等金属制成不锈钢 B.在铁制品表面镀锌
C.提高铁中含碳量,制成生铁 D.将水库铁闸门与直流电源的负极相连.
查看习题详情和答案>>
| T(K) | K1 | K2 |
| 973 | 1.47 | 2.36 |
| 1173 | 2.15 | 1.67 |
A.缩小反应容器容积 B.扩大反应容器容积 C.降低温度
D.升高温度 E.使用合适的催化剂 F.设法减少CO的量
(2)若反应Fe(s)+CO2(g)?FeO(s)+CO(g)在温度T1下进行;Fe(s)+H2O(g)?FeO(s)+H2(g)在温度T2下进行,已知T1>T2,且c(CO2)>c(H2O)(其他条件均相同),则两者的反应速率
A.前者大 B.后者大 C.一样大 D.无法判断
II.(1)钢铁的表面发蓝、发黑处理是常用的防腐方法.请配平主要反应的方程式:
(2)钢铁经冷、浓HNO3处理后“钝化”能达到防腐目的,不同浓度的HNO3与铁反应的还原产物很复杂,其分布曲线如下图.

①图示可知,分析HNO3与铁反应的规律是
②工业上一般不用冷浓硝酸进行铁表面处理,其可能的原因是
(3)金属(M)的腐蚀是因为发生反应:M-ne-→Mn+,除了上述表面处理的方法外,下列方法也能起到防腐作用的是
A.在铁中掺入铬等金属制成不锈钢 B.在铁制品表面镀锌
C.提高铁中含碳量,制成生铁 D.将水库铁闸门与直流电源的负极相连.
下列三个化学反应的平衡常数(K1、K2、K3)与温度的关系分别如表所示:请回答:
(1)反应①是
(2)写出反应③的平衡常数K3的表达式
.
(3)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=
(用K1、K2表示).
(4)要使反应③在一定条件下建立的平衡向逆反应方向移动,可采取的措施有
A.缩小反应容器的容积 B.扩大反应容器的容积 C.升高温度
D.使用合适的催化剂 E.设法减小平衡体系中的CO的浓度
(5)若反应③的逆反应速率与时间的关系如图所示:

①可见反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了一种条件,试判断改变的是什么条件:t2时
②若t4时降压,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系线.
查看习题详情和答案>>
| 化学反应 | 平衡常数 | 温度 | |
| 973K | 1173K | ||
| ①Fe(s)+CO2(g)?FeO(s)+CO(g) | K1 | 1.47 | 2.15 |
| ②Fe(s)+H2O(g)?FeO(s)+H2(g) | K2 | 2.38 | 1.67 |
| ③CO(g)+H2O(g)?CO2(g)+H2(g) | K3 | ? | ? |
吸热
吸热
(填“吸热”或“放热”)反应.(2)写出反应③的平衡常数K3的表达式
| C(CO2).C(H2) |
| C(CO).C(H2) |
| C(CO2).C(H2) |
| C(CO).C(H2) |
(3)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=
| K2 |
| K1 |
| K2 |
| K1 |
(4)要使反应③在一定条件下建立的平衡向逆反应方向移动,可采取的措施有
CE
CE
(填写字母序号).A.缩小反应容器的容积 B.扩大反应容器的容积 C.升高温度
D.使用合适的催化剂 E.设法减小平衡体系中的CO的浓度
(5)若反应③的逆反应速率与时间的关系如图所示:

①可见反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了一种条件,试判断改变的是什么条件:t2时
增大生成物浓度或升高温度
增大生成物浓度或升高温度
; t8时增大压强或使用催化剂
增大压强或使用催化剂
.②若t4时降压,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系线.
将1.00mol二氧化硫和1.00mol氧气通入1.00L的密闭容器中,分别在500K、600K、700K三个不同的温度下进行2SO2+O2?2SO3反应,反应过程中SO3浓度随时间的变化如下面表格所示:
表一:500K
表二:600K
表三:700K
(1)从上面三个表的数据可以判断该反应是 反应(填吸热或放热),利用表一计算0-40min内用
SO2表示该反应的化学反应速率v(SO2)= mol/L?min;
(2)对该反应,下面的说法正确的是 ;(双选)
A.当容器中的压强不再变化时,该反应就达到平衡
B.达到平衡时v正(SO2)=v逆(SO3)
C.平衡时c(SO2)=c(SO3)
D.当由500K平衡状态时升高温度至600K时,重新达到平衡状态时,容器的压强减少
(3)从上面三个表的数据,温度对应该反应的反应速率和平衡移动的影响是 ;
(4)计算在600K时的平衡常数(写出计算过程,最后结果取两位有效数字) ;
(5)下图曲线(Ⅰ)是在500K时SO3浓度的变化曲线,请你在图中画出在550K进行上述反应的曲线,并标明曲线(Ⅱ).
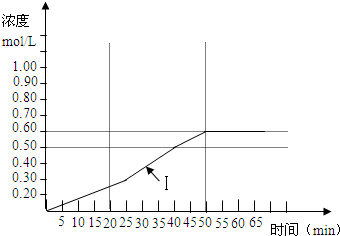
查看习题详情和答案>>
表一:500K
| 时间(min) | 0 | 5 | 10 | 15 | 20 | 25 | 30 | 35 | 40 | 45 | 50 | 55 |
| SO3 浓度(mol/L) |
0 | 0.1 | 0.15 | 0.20 | 0.25 | 0.30 | 0.35 | 0.40 | 0.50 | 0.55 | 0.60 | 0.60 |
| 时间(min) | 0 | 5 | 10 | 15 | 20 | 25 |
| SO3浓度(mol/L) | 0 | 0.2 | 0.30 | 0.40 | 0.50 | 0.50 |
| 时间(min) | 0 | 5 | 10 | 15 | 20 | 25 |
| SO3浓度(mol/L) | 0 | 0.25 | 0.35 | 0.35 | 0.35 | 0.35 |
SO2表示该反应的化学反应速率v(SO2)=
(2)对该反应,下面的说法正确的是
A.当容器中的压强不再变化时,该反应就达到平衡
B.达到平衡时v正(SO2)=v逆(SO3)
C.平衡时c(SO2)=c(SO3)
D.当由500K平衡状态时升高温度至600K时,重新达到平衡状态时,容器的压强减少
(3)从上面三个表的数据,温度对应该反应的反应速率和平衡移动的影响是
(4)计算在600K时的平衡常数(写出计算过程,最后结果取两位有效数字)
(5)下图曲线(Ⅰ)是在500K时SO3浓度的变化曲线,请你在图中画出在550K进行上述反应的曲线,并标明曲线(Ⅱ).
