网址:http://m.1010jiajiao.com/timu3_id_3941661[举报]
化学反应变化过程及结果的研究。按要求回答问题:
(1)关于反应过程中能量变化的研究:
则:2CO(g)+O2(g)=2CO2(g)△H= kJ·mol-1。
(2)关于反应速率和限度的研究:
工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:
2NH3 (g)+ CO2 (g)  CO(NH2)2 (l) + H2O (l),该反应的平衡常数(K)和温度(T / ℃)关系如下:
CO(NH2)2 (l) + H2O (l),该反应的平衡常数(K)和温度(T / ℃)关系如下:
| T / ℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
①焓变ΔH _______0 (填“>”、“<”或“=”)。
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)
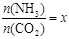 ,下图(1)是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是 。
,下图(1)是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是 。
③上图中的B点处,NH3的平衡转化率为 。
(3)关于电化学的研究:
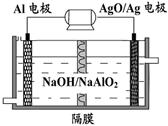
铝是日常生活中用途最多的金属元素,下图为Al-AgO电池的构造简图,电解质溶液为NaOH,它可用作水下动力电源,该电池中铝电极反应式为 。用该电池电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图如下图(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。电解时,阳极的电极反应式为 。

(4)关于电离平衡的研究:
人体血液里存在重要的酸碱平衡:
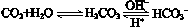 ,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随c(HCO3-)∶c(H2CO3)变化关系如下表:
,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随c(HCO3-)∶c(H2CO3)变化关系如下表:| c(HCO3-)∶c(H2CO3) | 1.0 | 17.8 | 20.0 | 22.4 |
| pH | 6.10 | 7.35 | 7.40 | 7.45 |
试回答:
正常人体血液中,HCO3-的水解程度 电离程度(填“大于”、“小于”、“等于”);
②人体血液酸中毒时,可注射缓解 (填选项);
A.NaOH溶液 B.NaHCO3溶液 C.NaCl溶液 D.Na2SO4溶液
③ pH=7.00的血液中,c(H2CO3) c(HCO3-) (填“<”、“>”、“=”) 查看习题详情和答案>>
(1)膦(PH3)是一种无色有剧毒的气体,其还原能力比氨(NH3)强,是一种强还原剂,但膦在水中的溶解度远小于氨,微溶于水。某反应体系中存在下列物质:Cu、H2SO4、CuSO4、PH3、H3PO4、H2O。回答下列问题:ks5u
①上述反应体系中化学反应方程式为__ ;
 ②膦(PH3)在水中的溶解度远小于氨的原因是___ 。
②膦(PH3)在水中的溶解度远小于氨的原因是___ 。
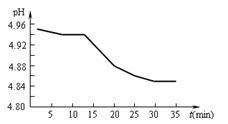
(2)SO2的排放是造成酸雨的主要因素。某地区酸雨 pH随时间的变化如下图所示。请用化学方程式表示该地区酸雨pH随时间增加而减小的原因:
(3)生活污水中含大量细小的悬浮物,可加入某些物质使之聚集成较大的颗粒而沉淀。请你举一种常见的能使生活污水中悬浮物聚沉的物质,其化学式为 。若生活污水中含大量的氮化合物,通常用生物膜脱氮工艺进行处理:首先在消化细菌的作用下将NH4+氧化为NO3-:NH4++2O2=NO3-+2H++H2O,然后加入甲醇,NO3-和甲醇转化为两种无毒气体。请写出加入甲醇后反应的离子方程式 。
(4)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g) 4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1
CH4(g)+4NO(g) 2N2(g)+CO2(g)+2H2O(g) ΔH2
若1mol CH4还原NO2至N2,整个过程中放出的热量为867kJ,则ΔH2= 。
查看习题详情和答案>>I.科学家一直致力于“人工固氮”的新方法研究。
(l)目前合成氨技术原理为:![]() △
△![]()
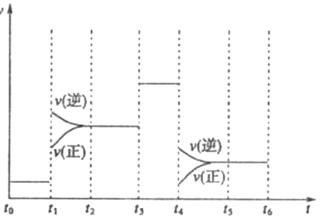 下图表示工业合成氨反应在某一段时间中反应速率与反应过程的关系曲线图:
下图表示工业合成氨反应在某一段时间中反应速率与反应过程的关系曲线图:
①氢化物的体积分数最高的一段时间为 ;![]() 时刻改变的反应条件是 。
时刻改变的反应条件是 。
②![]() 极易溶于水,其水溶液俗称氨水。用水稀释
极易溶于水,其水溶液俗称氨水。用水稀释![]() 的氨水,溶液中随着水量的增加而减小的是 (填序号)。
的氨水,溶液中随着水量的增加而减小的是 (填序号)。
![]()
![]()
![]()
![]()
(2)1998年希腊亚里士多德大学的两位科学家采用高质子导电性的SCY冉瓷(能传递![]() ),实现了高温常压下利用
),实现了高温常压下利用![]() 和
和![]() 电解合成氨。其阴极的电极反应式 。
电解合成氨。其阴极的电极反应式 。
(3)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,![]() 在催化剂(掺有少量
在催化剂(掺有少量![]() 的
的![]() )表面与水发生下列反应:
)表面与水发生下列反应:
![]() △
△![]() 进一步研究
进一步研究![]() 生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表
生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表
| 303 | 313 | 323 |
| 4.8 | 5.9 | 6.0 |
①此合成反应的![]() 0,△
0,△![]() 0,(填“>”“<”或“=”)。
0,(填“>”“<”或“=”)。
②已知:![]() △
△![]() ;
;
![]() △
△![]()
则![]() △
△![]() = 。
= 。
II.已知可逆反应![]() (未配平)△
(未配平)△![]() 。温度为
。温度为![]() 时,在容积固定的容器中发生反应,各物质的浓度随时间变化的关系如图
时,在容积固定的容器中发生反应,各物质的浓度随时间变化的关系如图![]() 所示。
所示。
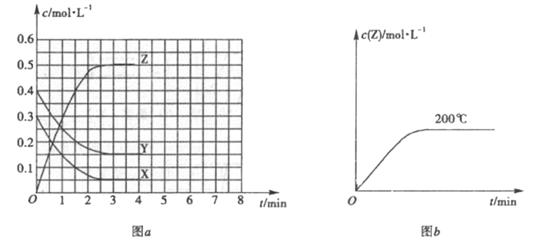
(1)![]() ℃时,该反应的平衡常数为
℃时,该反应的平衡常数为
(2)图![]() 为200℃时容器内
为200℃时容器内![]() 的变化曲线,请在图中补画该反应在100℃时的
的变化曲线,请在图中补画该反应在100℃时的![]() 的
的
变化曲线。
查看习题详情和答案>>