题目内容
(1)膦(PH3)是一种无色有剧毒的气体,其还原能力比氨(NH3)强,是一种强还原剂,但膦在水中的溶解度远小于氨,微溶于水。某反应体系中存在下列物质:Cu、H2SO4、CuSO4、PH3、H3PO4、H2O。回答下列问题:ks5u
①上述反应体系中化学反应方程式为__ ;
 ②膦(PH3)在水中的溶解度远小于氨的原因是___ 。
②膦(PH3)在水中的溶解度远小于氨的原因是___ 。
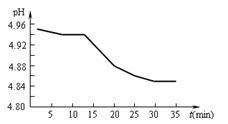
(2)SO2的排放是造成酸雨的主要因素。某地区酸雨 pH随时间的变化如下图所示。请用化学方程式表示该地区酸雨pH随时间增加而减小的原因:
(3)生活污水中含大量细小的悬浮物,可加入某些物质使之聚集成较大的颗粒而沉淀。请你举一种常见的能使生活污水中悬浮物聚沉的物质,其化学式为 。若生活污水中含大量的氮化合物,通常用生物膜脱氮工艺进行处理:首先在消化细菌的作用下将NH4+氧化为NO3-:NH4++2O2=NO3-+2H++H2O,然后加入甲醇,NO3-和甲醇转化为两种无毒气体。请写出加入甲醇后反应的离子方程式 。
(4)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g) 4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1
CH4(g)+4NO(g) 2N2(g)+CO2(g)+2H2O(g) ΔH2
若1mol CH4还原NO2至N2,整个过程中放出的热量为867kJ,则ΔH2= 。
(1)①PH3+4CuSO4+4H2O=4Cu+H3PO4+4H2SO4
②NH3能与水形成氢键而PH3不能
(2) (1)2H2SO3+O2=2H2SO4
(3)KAl(SO4)2·12H2O 6NO3-+5CH3OH+6H+=3N2↑+5CO2↑+13H2O
(4)-1160 kJ·mol-1

 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案
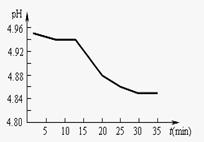 (2)SO2的排放是造成酸雨的主要因素。某地区酸雨
(2)SO2的排放是造成酸雨的主要因素。某地区酸雨