摘要:(二)汽化和液化: 1.汽化是物质由 变为 的过程.液体汽化时要 大量的热.它有两种表现形式 和 .两者有以下联系点:相同点: 不同点: (1) , (2) , (3) ,(4)蒸发时会从液体内部 .具有 效果, 沸腾时需从外界 大量的热. 2.影响同种液体蒸发快慢的因素有 . . . . 举例说明.加快蒸发的例子: .减慢蒸发的例子: . 3.人能利用 的蒸发来调控体温.人的正常体温一般保持在 之间.正常体 温是体内 和 维持相对平衡的结果.医生给发烧病人身上擦酒精使病人体温 . 4.在水沸腾实验中.最后根据实验记录只有98摄氏度的原因是: .在沸腾前 看到了气泡从水中冒出来的原因是: .体积变化情况是: .在沸腾时看到了气泡从水中冒出来体积变化情况是 . 5.沸点低的物质在实际生活中有特殊的作用.冷冻疗法就是利用 的特性.让其 在常温下迅速 .而暂时失去痛感. 6.液化是物质从 变为 的过程.气体液化时要 大量的热.所以100℃的水蒸气 比100℃的沸水对人的烫伤要 得多.水蒸气是无色.无味的气体.人眼是看不见的.烧 开水时水面出现大量的“白气 是高温水蒸气遇冷空气后 成的小水珠. 7.要使液体液化的两种方法是: . .
网址:http://m.1010jiajiao.com/timu3_id_3941652[举报]
生物质资源是一种污染小的可再生能源,可由其制得多种化工原料,如甲醛、甲醇和二甲醚等.
(1)甲醛溶液可用于浸制生物标本,这主要是利用了甲醛的何种化学性质 .
(2)由生物质能获得的CO和H2,可以合成多种有机物.当CO和H2以物质的量1:1催化反应,其原子利用率达100%,合成的物质可能是 .
a.汽油 b.甲醇 c.甲醛 d.乙酸
(3)工业上合成甲醇的反应:CO(g)+2H2(g)?CH3OH(g)△H=-90.8kJ/mol.
若在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得
反应达到平衡时的有关数据如下:
下列说法正确的是 .
A.cl=c2 B.2Q1=Q3 C.KI=K3 D.a2+a3<100%
(4)一定温度和压强下,CO和H2催化合成二甲醚的反应为:
3H2 (g)+3CO (g) CH3OCH3 (g)+CO2(g)
若一体积可变的密闭容器中充入3mol H2、3molCO、l mol CH3OCH3、l mol CO2,经一定时间达到平衡,并测得平衡时混合气体密度是同温同压下起始时的1.6倍.平衡时
n(CH3OCH3)= mol.反应开始时正、逆反应速率的大小:v(正) v(逆)(填‘‘>’’、“<”或“=”),理由是 .
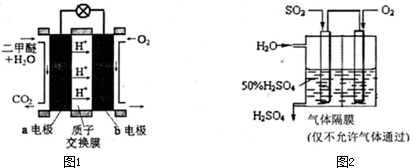
(5)如图1为绿色电源“直接二甲醚燃料电池”的工作原理示意图.b电极是 极,a电极的反应式为 .
(6)利用生物质资源过程中会产生SO2,可利用如图2所示装置,用电化学原理生产硫酸为稳定持续生产,硫酸溶液的浓度应维持不变,则通入SO2和水的质量比为 .
查看习题详情和答案>>
(1)甲醛溶液可用于浸制生物标本,这主要是利用了甲醛的何种化学性质
(2)由生物质能获得的CO和H2,可以合成多种有机物.当CO和H2以物质的量1:1催化反应,其原子利用率达100%,合成的物质可能是
a.汽油 b.甲醇 c.甲醛 d.乙酸
(3)工业上合成甲醇的反应:CO(g)+2H2(g)?CH3OH(g)△H=-90.8kJ/mol.
若在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得
反应达到平衡时的有关数据如下:
| 1.容器 | 2.甲 | 3.乙 | 4.丙 |
| 5.反应物投入量 | 6.1molCO、2molH2 | 7.l molCH3OH | 8.2molCO、4molH2 |
| 9.CH30H昀浓度(mol/L) | 10.cl | 11.c2 | 12.c3 |
| 13.反应的能量变化 | 14.放出Q1kJ | 15.吸收Q2kJ | 16.放出Q3kJ |
| 17.平衡常数 | 18.Kl | 19.K2 | 20.K3 |
| 21.反应物转化率 | 22.al | 23.a2 | 24.a3 |
A.cl=c2 B.2Q1=Q3 C.KI=K3 D.a2+a3<100%
(4)一定温度和压强下,CO和H2催化合成二甲醚的反应为:
3H2 (g)+3CO (g) CH3OCH3 (g)+CO2(g)
若一体积可变的密闭容器中充入3mol H2、3molCO、l mol CH3OCH3、l mol CO2,经一定时间达到平衡,并测得平衡时混合气体密度是同温同压下起始时的1.6倍.平衡时
n(CH3OCH3)=

(5)如图1为绿色电源“直接二甲醚燃料电池”的工作原理示意图.b电极是
(6)利用生物质资源过程中会产生SO2,可利用如图2所示装置,用电化学原理生产硫酸为稳定持续生产,硫酸溶液的浓度应维持不变,则通入SO2和水的质量比为
(14分)工业废气、汽车尾气排放出的SO2、NOx等,是形成雾霾的重要因素。霾是由空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾。
(1)大气中的SO2在烟尘的催化下形成硫酸的反应方程式是____________________。
(2)已知2SO2 (g)+ O2 (g) 2SO3(g) △H=-196kJ/mol,提高反应中SO2的转化率,是减少SO2排放的有效措施。
2SO3(g) △H=-196kJ/mol,提高反应中SO2的转化率,是减少SO2排放的有效措施。
①T温度时,在2L容积固定不变的密闭容器中加入2.0 mol SO2和1.0 mol O2,5 min后反应达到平衡,二氧化硫的转化率为50%,则υ(O2)=____________。
②在①的条件下,判断该反应达到平衡状态的标志是_______(填字母)。
| A.SO2、O2、SO3三者的浓度之比为2∶1∶2 | B.容器内气体的压强不变 |
| C.容器内混合气体的密度保持不变 | D.SO3的物质的量不再变化 |
③若反应初始时,在容器中加入1.5 mol SO2和0.8 mol O2,则平衡后二氧化硫的转化率 氧气的转化率(填大于、小于或等于)。
(3)烟气中的SO2可以用NaOH溶液吸收,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如下图所示。(电极材料为石墨)
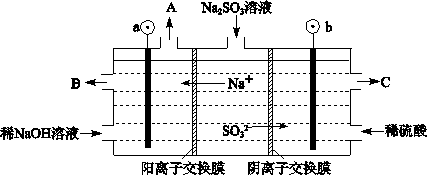
①图中a极要连接电源的(填“正”或“负”)_______极,C口流出的物质是_______。
②SO32-放电的电极反应式为_____________________________________。
③电解过程中若消耗12.6gNa2SO3,则阴极区变化的质量为_______g(假设该过程中所有液体进出口密闭)。 查看习题详情和答案>>